
【题目】下列有关滴定的说法正确的是( )
A. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中混有NaOH杂质,则结果偏低。
B. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高锰酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
C. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
D. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
【答案】A
【解析】A. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中混有NaOH杂质,由于氢氧化钠的摩尔质量较小,则所配标准溶液中OH-浓度较大,滴定时消耗标准溶液体积偏小,所以测定结果偏低。A正确;B. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去高锰酸钾溶液体积为V1mL,由两者反应中化合价升降总数相等(或电子转移守恒)可得到关系式5H2C2O4~2KMnO4,则n(H2C2O4)=2.5n(KMnO4)=2.5 ![]() ,所以H2C2O4溶液的浓度为
,所以H2C2O4溶液的浓度为![]() mol/L,B不正确;C. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,则未知盐酸的体积偏小,导致测定结果偏高,C不正确;D.滴定管的读数要精确到0.01mL,D不正确。本题选A。
mol/L,B不正确;C. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,则未知盐酸的体积偏小,导致测定结果偏高,C不正确;D.滴定管的读数要精确到0.01mL,D不正确。本题选A。


科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) ![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是

A.图一t2时改变的条件可能是升高了温度或使用了催化剂
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、NH4+、Cl、HCO3B.Na+、NO3、SO42-、Fe2+
C.Na+、Mg2+、Cl、SO42-D.Fe3+、K+、Cl、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是

A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳酸氢钠和碳酸钠的说法正确的是( )
A.加热时均可以分解产生气体
B.与盐酸反应的离子反应方程式一样
C.都可以与盐酸反应生成气体
D.碳酸钠俗称小苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是( )
A.铁与水蒸气在高温下的反应产物为Fe2O3和H2
B.氢氧化亚铁是红褐色沉淀
C.Fe3+与KSCN溶液产生红色沉淀
D.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
C | 2NO2(g) | 加压平衡向着气体颜色加深的方向移动 |
D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里做钠跟水反应的实验时,用到的仪器和药品是( )
①试管 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A. ①②③④ B. ②③④⑥⑨ C. ③④⑧⑨⑩ D. ②⑤⑦⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水、易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
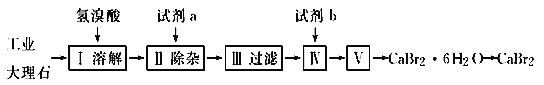
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸500 mL,所需的玻璃仪器有玻璃棒、________________________。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是__________,控制溶液的pH约为8.0的目的是________________________。
(3)试剂b是__________,步骤Ⅳ的目的是________________________________。
(4)步骤Ⅴ所含的操作依次是____________________。
(5)制得的溴化钙可以通过如下步骤测定其纯度:①称取4.00 g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④__________;⑤称量。若得到1.88 g碳酸钙,则溴化钙的质量分数为__________(保留两位有效数字)。若实验操作规范而测定结果偏低,其原因是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com