
【题目】前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是

A. 简单离子半径:Z>Y
B. 反应①为吸热反应
C. 反应②为工业上制备漂白粉的反应原理
D. X、Y分别与Z形成的化合物中,化学键类型一定相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于下列反应的说法中正确的是( )
A. 2CuFeS2+O2===Cu2S+2FeS+SO2,CuFeS2是氧化剂,O2是还原剂
B. 3NO2+H2O===2HNO3+NO,氧化产物与还原产物的物质的量之比为2∶1
C. 反应KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,生成3molCl2,转移电子6mol
D. Cr2O![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
+6Fe2++14H+===2Cr3++6Fe3++7H2O,说明还原性Cr3+> Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
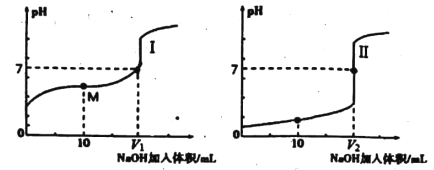
(1)用NaOH溶液滴定醋酸溶液通常所选择的指示剂为________;符合其滴定曲线的是______(填“I”或“Ⅱ”)。
(2)图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”)。
(3)滴定前的上述三种溶液中。由水电离出的c(H+)最大的是_____溶液(填化学式)。
(4)若用0.1mol/LNaOH溶液滴定未知浓度的醋酸,滴定前仰视,滴定后平视,则所测结果____(填“偏低”,“偏高”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,集气瓶内充满某混合气体(括号内为体积比),若将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,则集气瓶中的混合气体可能是( )
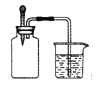
①CO、O2 (2:1) ②NH3 、O2(8:1)③NO2、O2(4:1) ④N2、H2(1:3)
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常条件下,NO2和SO2可以很容易发生反应生成NO和SO3。现将碳跟浓硫酸共热产生的气体X和碳跟浓硝酸共热产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
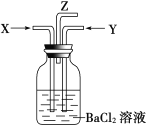
A. 洗气瓶中产生的沉淀是碳酸钡
B. 洗气瓶中产生的沉淀是硫酸钡
C. 在Z导管出来的气体中无二氧化碳
D. 反应一段时间后洗气瓶中溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.Fe在氯气中燃烧生成FeCl2
B.将AlCl3溶液逐滴滴入到NaOH溶液,先产生白色沉淀,最后沉淀消失
C.电解氯化钠溶液制取金属单质钠
D.常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl和Cl-两种粒子中,不相同的是···( )
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数
A. ①② B. ②③ C. ③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于合成树脂的四溴双酚F、药物透过性材料高分子化合物PCL合成如下。
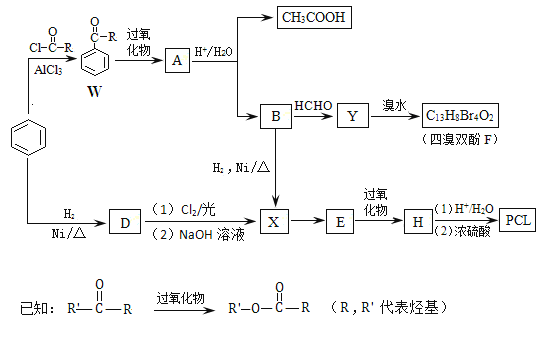
(1)W中—R是_________________________________。
(2)A的结构简式是_____________________________。
(3)A生成B和CH3COOH的反应类型是________________________。
(4)D→X过程中所引入的官能团分别是_________________________。
(5)E的分子式是C6H10O,E与H2反应可生成X。H的结构简式是____________________。
(6)有机物Y的苯环上只有2种不同化学环境的氢原子。
① 由B生成Y的反应方程式是___________________________________。
② 由Y生成四溴双酚F的反应方程式是_______________________________。
③ 在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,其结构简式可能是_________________________________。
(7)高分子化合物PCL的结构简式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
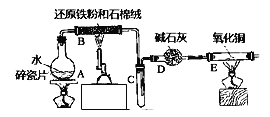
(1)装置B中发生反应的化学方程式是__________.
(2)E中出现的现象是________.
(3)该小组把B中反应后的产物加入到足量的盐酸中,用该溶液制取FeCl36H2O晶体.
①欲检验溶液中含有Fe3+,选用的试剂为_________,现象是________.
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因:__.
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的_______.
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化,实验方法是:_______.
(4)请写出向FeCl2溶液中加入NaOH溶液产生的白色沉淀最后变成红褐色沉淀的化学方程式_______, 该反应中消耗1mol氧化剂转移 _______ mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com