
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下:

已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有______________(任写一条);过滤1的滤渣的主要成分有__________(填化学式)。
(2)浸取时加入过量浓盐酸的目的是________________________________;“母液”中通入气体X后可循环利用,气体X为______________(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式_______________________________,当消耗标准状况下4.48 L O2时,转移电子的数目是__________。
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当Pb2+恰好沉淀完全时,所得溶液中c(Cu2+)∶c(Bi3+)=______。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
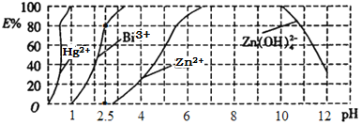
①当调节pH=2.5时,铋(Bi)的存在形式有________________________。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____________________________________。
【答案】粉碎矿石、适当提高浸取时温度、适当提高溶液浓度、搅拌等 S、SiO2 防止 FeCl3及 BiCl3水解生成不溶性沉淀,提高原料的浸出率 氯气 2Bi+2O2+Na2O2 =2NaBiO3 NA或 6.02×1023 10-11∶1 Bi3 +、Bi(HDz)3 Bi(HDz)3+6OH-=Bi(OH)3 ↓+3H2O+3Dz2-
【解析】
由流程图可知,辉铋矿中含有Bi2S3和少量SiO2,加入浓盐酸和氯化铁后,氯化铁将硫离子氧化成单质硫。通过过滤1除去S、SiO2。再加入单质铁将Bi3+还原成Bi单质,经过提纯后得到精铋,最后在焙烧条件下得到NaBiO3,据此分析;
(1)为了提高浸取速率,可采取的措施有粉碎矿石、适当提高浸取时温度、适当提高溶液浓度、搅拌等;浸取过程中,二氧化硅不反应,三价铁将硫离子氧化成单质硫,过滤1的滤渣的主要成分有S、SiO2;
(2)Bi3+和Fe3+会发生水解,加入浓盐酸可以抑制这两种离子的水解,提高原料的浸出率;母液中含有大量氯化亚铁,通入氯气后,将亚铁离子氧化得到氯化铁,即可循环使用;
(3)焙烧时,铋与氧气、过氧化钠反应生成NaBiO3,结合元素守恒和得失电子守恒可得到反应方程式为:2Bi+2O2+Na2O2 =2NaBiO3;当消耗标准状况下4.48 L O2,即0.2mol O2时,转移电子的数目是:NA或 6.02×1023;
(4)当Pb2+恰好沉淀完全时,c(S2-)=Ksp(PbS)/c(Pb2+)=3.0×10-28/10-5=3.0×10-23 mol·L-1,此时,c(Cu2+)=Ksp(CuS)/c(S2-)=6.0×10-36/3.0×10-23=2×10-13mol·L-1。溶液中c(Bi3+)=0.02mol·L-1,Q= c2(Bi3+)·c3(S2-)< Ksp(Bi2S3),所以,此时Bi3+没有沉淀。c(Cu2+)∶c(Bi3+)=2×10-13:0.02=10-11∶1;
(5)H2Dz将Bi3+络合成电中性的Bi(HDz)3,当调节pH=2.5时,由图可知,80%的Bi3+以络合物形式被萃取分离,故铋(Bi)的存在形式有Bi3 +、Bi(HDz)3;向Bi(HDz)3中加入氢氧化钠,铋元素转化为Bi(OH)3沉淀,由于H2Dz为二元酸,故加入氢氧化钠后HDz-转化为Dz2-和水,反应方程式为:Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-;


科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
A. 溶液中导电粒子的数目增加,导电性增强
B. 醋酸的电离程度增大,pH增大
C. 再加入10mLpH=11NaOH溶液,混合液pH>7
D. 溶液中c(CH3COO—)/c(CH3COOH)c(OH—)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)在下列化学方程式中,双线桥法标出电子转移并填空。3S+6KOH![]() K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
K2SO3+2K2S+3H2O___,氧化剂___,还原剂___;2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑___,氧化剂___,被氧化的物质_____;3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O___,被还原的物质_____,还原剂______。
(2)请把符合要求的化学反应方程式的编号填入括号内:是分解反应又是氧化还原反应的是___,是分解反应不是氧化还原反应的是___,是化合反应又是氧化还原反应的是___,是化合反应不是氧化还原反应的是___,不属于四种基本反应类型的氧化还原反应的是___。
A.2KClO3![]() 2KCl+3O2↑ B.2Fe+3Cl2
2KCl+3O2↑ B.2Fe+3Cl2![]() 2FeCl3 C.NH4HCO3
2FeCl3 C.NH4HCO3![]() NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
NH3↑+H2O+CO2↑D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
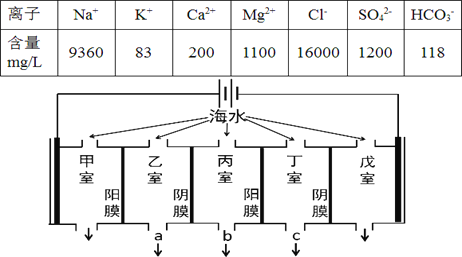
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的BaSO4固体溶于50 mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(![]() )增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是
)增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是

A. 该温度下Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体,立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(![]() )∶c(
)∶c(![]() )=25
)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某氧原子的质量是a g,12C原子的质量为b g,用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.氧元素的相对原子质量一定是12a/b
B.该氧原子的摩尔质量是![]()
C.W g该氧原子的物质的量一定是![]()
D.W g该氧原子所含的质子数是W/a个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为“镁﹣次氯酸盐”燃料电池原理示意图。图2为“双极室成对电解法”生产乙醛酸原理示意图,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是

A. 若利用镁燃料电池为电源,则E极连M极
B. 镁燃料电池负极容易与水发生自腐蚀产生氢气
C. F电极上的电极反应式为ClO-+2e-+H2O=Cl-+2OH-
D. 图2装置中若有2 mol H+通过质子交换膜完全反应,则共生成2 mol乙醛酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com