
| A. | pH=1的溶液中:K+ CH3COO- SO42- Na+ | |
| B. | 含有0.1mol/LCa2+的溶液中:Na+SO42- K+ Cl- | |
| C. | 含有0.1mol/LMg2+的溶液中:Na+SO42- K+ HCO3- | |
| D. | 滴入酚酞显红色的溶液:K+ HCO3-Ba2+Cl- |
科目:高中化学 来源: 题型:实验题
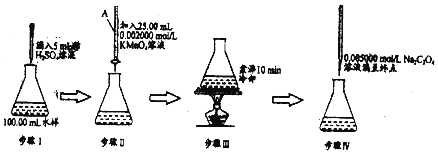
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | $\frac{1}{2}$CO2(g)+H2O(l)═$\frac{1}{2}$CH4(g)+O2(g)△H=+445 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.625 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃时,铝的密度为2.7 g/cm3,则1个Al原子的体积为($\frac{10}{{N}_{A}}$)cm3 | |
| B. | 25℃、101KPa下,16 g O2与O3的混合气体中含电子数为8NA | |
| C. | 25℃、101KPa下,11.2L Cl2含有的分子数小于0.5NA | |
| D. | 0℃、101KPa下,等体积的CH4和CCl4中含C原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com