
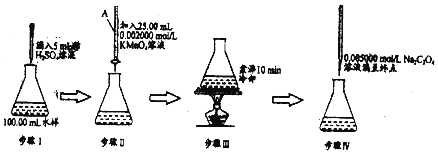
分析 (1)滴定管中注入酸性高锰酸钾前应先用蒸馏水洗涤,后再用KMnO4标准溶液润洗2-3次;
(2)开始较慢,随后反应速率加快说明生成的锰离子起了催化作用;
(3)根据步骤IV滴定消耗的Na2C2O4溶液的量计算过量的KMnO4物质的量,从而求出与水样反应的KMnO4物质的量,最后根据得失电子守恒再转化成消耗氧气的量;
(4)实验测量结果比实际有机物含量偏高,可能是读取数据时把滴定管中消耗溶液体积读大了.
解答 解:(1)滴定管中注入酸性高锰酸钾前应先用蒸馏水洗涤,后再用KMnO4标准溶液润洗2-3次;故答案为:用KMnO4标准溶液润洗2-3次;
(2)步骤 IV实验过程中滴入第一滴Na2C2O4溶液时褪色较慢,以后的滴定中褪色较快,说明反应中生成的锰离子对反应起到催化剂的作用,
故答案为:随着反应的进行,生成的Mn2+可作为反应的催化剂;
(3)设过量的KMnO4物质的量为x,
由2MnO4-+5C2C42-+16H+=2Mn2++10CO2↑+8H2O
2 5
x 0.00500mol/L×0.02L
则x=$\frac{0.00500mol/L×0.02L×2}{5}$=4×10-5mol
所以与水样反应的KMnO4为0.00200mol/L×25×10-3L-4×10-5mol=10-5mol
MnO4-生成Mn2+得5e-,O2生成H2O得4e-,根据得失电子守恒,与水样反应的KMnO4转化成消耗氧气的量为=10-5mol×$\frac{5}{4}$=1.25×10-5mol,
化学耗氧量COD值为$\frac{1.25×10{\;}^{-5}mol×32g/mol×10{\;}^{3}mg}{0.1L}$=4mg/L,故答案为:4mg/L;
(4)实验测量结果比实际有机物含量偏高,配制Na2C2O4标液定容时,可能是读取数据时把滴定管中消耗溶液体积读大了;
故答案为:俯.
点评 本题考查了物质组成的实验探究方法分析,过程理解应用,主要是物质性质的分析判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 滴定时可以用pH计或石蕊试液准则判断滴定终点 | |
| B. | 滴定前平视,滴定后俯视酸式滴定管,得出的滴定结果偏大 | |
| C. | 滴定前要用待测烧碱溶液洗涤锥形瓶 | |
| D. | 滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化,直到滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色加深 | |
| B. | 使用铁作催化剂,使N2和H2在一定条件下合成为NH3 | |
| C. | 可用排饱和食盐水法收集氯气 | |
| D. | 500℃时比室温更有利于合成氨的反应(已知合成氨的反应时放热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 补血口服液中添加维生素c,作为氧化剂 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ② | ⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+ CH3COO- SO42- Na+ | |
| B. | 含有0.1mol/LCa2+的溶液中:Na+SO42- K+ Cl- | |
| C. | 含有0.1mol/LMg2+的溶液中:Na+SO42- K+ HCO3- | |
| D. | 滴入酚酞显红色的溶液:K+ HCO3-Ba2+Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com