
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ② | ⑧⑨ |
分析 (1)根据物质的分类标准以及分类结果进行判断物质所属的类别,两种元素组成其中一种为氧元素的化合物为氧化物,分散质微粒直径1-100nm形成的分散系为胶体;
(2)在水溶液中和熔融状态下均不能导电的化合物是非电解质;盐酸是一种强酸具有酸的通性.
解答 解:(1)根据物质的元素组成,可以将物质分为纯净物和混合物,纯净物中,根据组成元素的种类可以将物质分为单质和化合物,只有一种元素组成的纯净物是单质,如氧气、铁,根据化合物的性质,可以将化合物分为酸、碱、盐、氧化物,如氧化钙、二氧化碳属于氧化物,根据混合物分散质微粒直径的大小,可以将混合物分为溶液(如硫酸钠溶液、稀硝酸)浊液和胶体(如红褐色的氢氧化铁液体)三种,化合物在水溶液或是熔融态下是否导电,可以将化合物分为电解质和非电解质,如CaO、H2SO4、Ba(OH)2、Cu2(OH)2CO3属于电解质,故答案为:
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ③④ | ⑦ |
点评 本题考查了物质分类的依据和分析判断,物质组成和性质是解题关键,题目难度中等.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | (b)(c)(d) | B. | (a)(d) | C. | (b)(c)(d)(e)(f) | D. | (b)(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
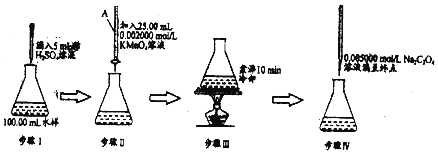
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
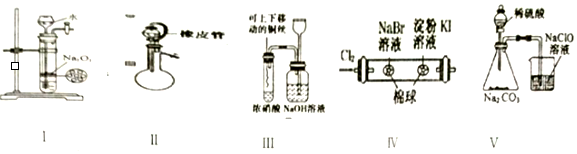
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | $\frac{1}{2}$CO2(g)+H2O(l)═$\frac{1}{2}$CH4(g)+O2(g)△H=+445 kJ/mol | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.625 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com