
【题目】分类是学习和研究化学的一种重要方法。下列有关Na2SO4的分类合理的是
A.属于碱B.属于碱性氧化物C.属于酸D.属于盐
科目:高中化学 来源: 题型:
【题目】已知物质A~K之间有如下图所示转化关系。其中A是一种易溶于水的离子化合物,在空气中易潮解和变质,在水中可以电离出电子总数相等的两种离子;E为生活中常用消毒剂的有效成分,F是生活中不可缺少的调味剂,G为无色液体,B、C、D、K都是单质;反应②~⑤都是重要的工业反应。(部分反应需要在溶液中进行)

(1)物质D中所含元素在周期表中的位置为____________________________,
E中所含化学键类型有___________________________________________,
M的结构式为___________________________________________________。
(2)反应④的离子方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格利雅试剂简称“格氏试剂”,它是卤代烃与金属镁在无水乙醚中作用得到的,它可与羰基发生加成反应,如: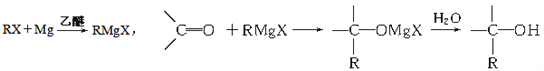
今欲通过上述反应合成2-丙醇,选用的有机原料正确的一组是
A. 氯乙烷和甲醛 B. 氯乙烷和丙醛
C. 一氯甲烷和丙酮 D. 一氯甲烷和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH4+的水解平衡常数为Kb=5.556×10 -10。该温度下,用0.100 mol·L-1的氨水滴定10.00ml 0.050 mol·L-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V 与溶液中lg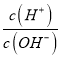 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
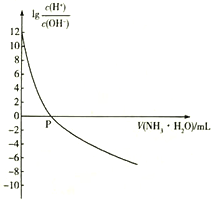
A. H2A的电离方程式为H2A![]() H++A2-
H++A2-
B. 25℃时,Kb(NH3·H2O)=1.8×10-5
C. P点时加入氨水的体积为10 mL
D. 向H2A溶液中滴加氨水的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移的电子数为2 NA
C. 转移电子的物质的量为1 mol时,生成标准状况下Cl2的体积为11.2 L
D. 每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共七种物质:O2,KMnO4,MnSO4,H2SO4,H2O,H2O2,K2SO4,已知H2O2只发生反应H2O2→O2,回答下列问题:
(1)该反应的氧化剂是________。
(2)氧化剂与还原剂的物质的量之比______________。
(3)若反应转移了0.3mol电子,则在标况下生成气体体积___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取H2时,该用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Al在氧气中燃烧生成A12O3 , 将Al片改成Al粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )
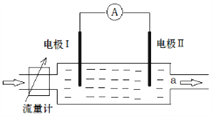
A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下问题:
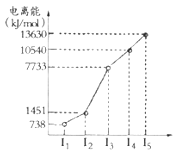
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。
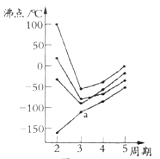
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。
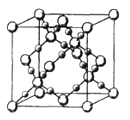
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
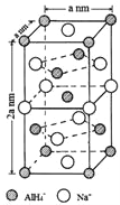
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com