
【题目】有机物A可用作果实催熟剂。某同学欲以A为主要原料合成乙酸乙酯,其合成路线如图所示。
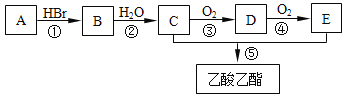
请回答:
(1)C分子中含有的官能团名称是___________; C的同分异构体的核磁共振氢谱只有一种类型氢原子的吸收峰,其结构简式是___________。
(2)反应①的反应类型是_________反应,反应 ②~⑤ 中反应类型相同的是_______和_______、_________和________(填序号)。
(3)由A可以直接转化为C,其反应的化学方程式是___________。
(4)反应②的化学方程式是____________,反应⑤的化学方程式是______。
(5)为了检验B中的溴元素,以下操作合理的顺序是________(填序号)。
a.加AgNO3 溶液 b.加NaOH 溶液 c.加热 d.加稀硝酸至溶液显酸性
【答案】CH3CH2OH 羟基 CH3OCH3 加成 3 4 2 5 CH2 = CH2 + H2O ![]() CH3CH2OH
CH3CH2OH
CH3CH2Br+NaOH![]() CH3CH2OH+NaBr CH3COOH+C2H5OH
CH3CH2OH+NaBr CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O bcda
CH3COOC2H5+H2O bcda
【解析】
根据图示合成路线中反应物及反应条件等信息,分析每步反应的产物及反应类型,进而分析有机物的结构及书写反应方程式。
有机物A可用作果实催熟剂,A为CH2=CH2,A和HBr发生加成反应生成B,B为CH3CH2Br,B发生取代反应生成C,C为CH3CH2OH,C被氧化生成D,D为CH3CHO,D被氧化生成E,E为CH3COOH,
(1)C是乙醇,C的结构简式是CH3CH2OH,分子中含有的官能团名称是羟基,C的同分异构体的核磁共振氢谱只有一种类型氢原子的吸收峰,其结构简式是CH3OCH3,
故答案为:羟基;CH3OCH3;
(2)A为CH2=CH2,A和HBr发生加成反应生成B,B为CH3CH2Br,所以反应①的反应类型是加成反应,根据上述分析②为取代反应,③为氧化反应,④为氧化反应,⑤为取代反应,所以③和④反应类型相同,②和⑤反应类型相同,
故答案为:加成;③、④;②、⑤;
(3)由A可以直接转化为C,其反应的化学方程式是:CH2 = CH2 + H2O ![]() CH3CH2OH;
CH3CH2OH;
故答案为:CH2 = CH2 + H2O ![]() CH3CH2OH;
CH3CH2OH;
(4)反应②是溴乙烷的水解反应,化学方程式是:CH3CH2Br+NaOH![]() CH3CH2OH+NaBr ,反应⑤是酯化反应,化学方程式是:CH3COOH+C2H5OH
CH3CH2OH+NaBr ,反应⑤是酯化反应,化学方程式是:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3CH2Br+NaOH![]() CH3CH2OH+NaBr,CH3COOH+C2H5OH
CH3CH2OH+NaBr,CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(5)溴乙烷中的溴元素不是以离子状态存在,因此,不能与AgNO3溶液直接反应,必须使之变为Br-,从题目中所给的信息,应通过溴乙烷在碱性水溶液水解得到Br-,但要注意,反应后溶液显碱性,不能直接加入AgNO3溶液检验,否则,Ag+与OH-反应得AgOH白色沉淀(AgOH不稳定,很快变为Ag2O暗棕色沉淀),影响溴的检验,所以,应加入足量硝酸使溶液变为酸性后,再加AgNO3溶液检验,
故答案为:bcda。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() X表示原子:
X表示原子:
①AXn+共有x个电子,则该阳离子的中子数N=____。
②12C16O2分子中的中子数N=______。
③A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为_____。
(2)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是_____。
(3)已知某粒子的结构示意图为![]()
试回答:①当x-y=10时,该粒子为___(填“原子”、“阳离子”或“阴离子”)。
②写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:

(1)探究BaCO3和BaSO4之间的转化,实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,__________
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_______。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______
(2)探究AgCl和AgI之间的转化,实验Ⅲ:
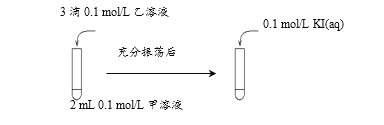
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。

注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是 _______________
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A——F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
(1)化合物A属于________类(按官能团种类分类)
(2)化合物B在一定条件下,可以与NaOH溶液发生反应,写出化合物B 与足量NaOH反应的化学方程式_____________。
(3)化合物C与D在一定条件下发生如图转化得到高分子化合物Z,部分产物已略去。

反应③中D与H2按物质的量1:1反应生成Y,则 生成Z的方程式为__________。
(4)化合物D与银氨溶液反应的化学方程式____________(有机物用结构简式表示):。
(5)写出符合下列条件的E的同分异构体的结构简式:_________。
A.苯环上只有一个取代基
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(6)化合物F是合成“克矽平”(一种治疗矽肺病的药物)的原料之一,其合成路线如下:(说明:克矽平中氮氧键是一种特殊的共价键;反应均在一定条件下进行。)
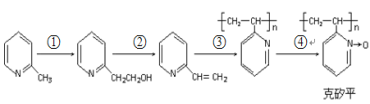
a.反应①是原子利用率100%的反应,则该反应的化学方程式为_____________;
b.上述转化关系中没有涉及的反应类型是(填代号)___________。
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,全球首条光伏高速公路亮相济南。下列有关说法不正确的是

A. 光伏发电将太阳能转变为电能
B. 汽车尾气中的CO2会造成酸雨
C. 光伏发电代替燃煤发电可减少雾霾
D. 光伏发电所用太阳能电池板的主要材料是硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是

A. 通常情况下,NO比N2稳定
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1molN2(g)和1molO2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com