
【题目】有机物H是一种广谱高效食品防腐剂,如图所示是H分子的球棍模型,下列有关说法正确的是

A. 有机物H的分子式为C9H11O3
B. 有机物H的官能团有羟基、羰基和醚键
C. 有机物H能发生加成反应、取代反应和氧化反应
D. 1mol有机物H最多可与1molNaOH反应
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是:
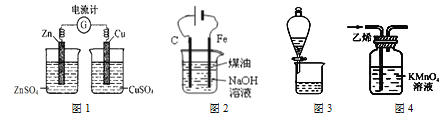
A.用图1装置用电流计检验电流的方向
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置除去C2H4中少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料乙醇的生产过程示意图如图所示:
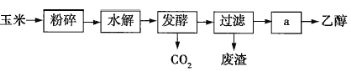
(1)粉碎玉米的目的是__________________________________。
(2)玉米中所含有机物的主要成分是________(填名称)。
(3)步骤a的操作是________(填名称)。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的![]() 的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
的纯度可达99%,可回收利用,请列举出它的两种用途: ________________________。
(5)用葡萄糖制乙醇的化学方程式可表示为![]() 。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
。根据上述反应式,可计算出100kg淀粉在理论上生产的无水乙醇为________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验I.探究Na2CS3的性质:
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
③ | 向另一份溶液中滴加硫酸酸化的KMnO4溶液,紫色褪去 |
(1)H2CS3是___(填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为___。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点并说明理由:___。
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0molL-1的稀H2SO4,关闭活塞。

已知:CS32-+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___。反应开始前需要先通入一段时间N2,其作用为___。
(5)B中发生反应的离子方程式为___。
(6)反应结束后打开活塞K,再缓慢通入一段时间的热N2,其目的是___。
(7)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液中存在平衡:
溶液中存在平衡:![]() 橙色
橙色![]() 黄色
黄色![]() 。用
。用![]() 溶液进行下列实验:
溶液进行下列实验:

结合实验,下列说法不正确的是![]()
![]()
A.![]() 中溶液橙色加深,
中溶液橙色加深,![]() 中溶液变黄
中溶液变黄
B.![]() 中
中![]() 被
被![]() 还原
还原
C.对比![]() 和
和![]() 可知
可知![]() 酸性溶液氧化性强
酸性溶液氧化性强
D.若向![]() 中加入
中加入![]() 溶液至过量,溶液变为橙色
溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铝土矿![]() 含
含![]() 、FeO、
、FeO、![]() 、
、![]() 中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量![]() :
:![]() 、
、![]() 、
、![]() 、
、![]()
B.通入过量氨气:![]() 、
、![]() 、
、![]() 、
、![]()
C.加入过量NaOH溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
D.加入过量NaClO溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
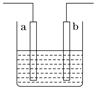
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. H2、I2、HI混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、![]() )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式: _________,指出使用空气比使用氯气好的原因是__________。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com