
【题目】将0.20 mol/L的盐酸和物质的量浓度为c mol/L的NaOH溶液按不同体积比配制成两种溶液。下表是配制时所取盐酸与 NaOH 溶液体积与混合后溶液中Na+与Cl-的物质的量浓度数据(忽略溶液体积变化):
溶液 | 混合前所取溶液体积(mL) | 混合后离子浓度(mol/L) | ||
HCl | NaOH | Na+ | Cl- | |
① | 30 | x | 1.5z | z |
② | 10 | y | z | 2z |
下列说法正确( )
A.x=90B.y=30C.z=0.10D.c=0.10
科目:高中化学 来源: 题型:
【题目】已知:A、B、F是家庭中常见的有机物,A和B碳原子数相等,E是石油化工发展水平的标志,F是一种常见的高分子材料。下面是几种物质的转化关系图:
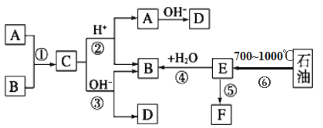
完成下列填空:
(1)操作⑥的名称为:_____________________________________,上述反应中属于取代反应的是___________(填序号)
(2)写出比B多两个碳原子,且不能发生非燃烧性氧化反应的同系物的结构简式:___。
(3)写出反应③所用的碱液为氢氧化钠溶液,写出反应③的化学方程式____________。
(4)写出F的名称________________________,反应⑤的反应类型为_________。
(5)写出检验B的催化氧化产物的化学方程式____________,实验现象是______。
(6)写出两个既能发生银镜反应又能发生酯化反应的C的同分异构体结构简式。
________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是( )

A.1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体
B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2
C.1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH
D.绿原酸水解产物均可以与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在测定硫酸铜晶体中结晶水含量的实验操作中:
(1)加热前应将晶体放在__________中研碎,加热是放在__________中进行,加热失水后,应放在__________中冷却。
(2)判断是否完全失水的方法是______________________________________________。
(3)下面是某学生一次实验的数据,请完成计算,填入下面的表格中。
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 测得晶体中结晶水个数 |
11.7 g | 22.7 g | 17. 6 g | _________ |
(4)这次实验中产生误差的原因可能是__________(填写字母)所造成。
A.硫酸铜晶体中含有易挥发性杂志 B.实验前晶体已部分变白
C.加热时固体部分变黑 D.加热失水后漏置在空气中冷却
(5)已知在坩埚中加热硫酸铜晶体,受热分解过程如下:
CuSO4·5H2O![]() CuSO4·3H2O
CuSO4·3H2O ![]() CuSO4·H2O
CuSO4·H2O ![]() CuSO4
CuSO4
有人借助如图封闭装置进行硫酸铜晶体脱水实验,回答下列问题:
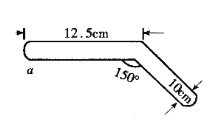
①本实验可用于验证的化学定律是_____________________________。
②a处加热片刻后现象:______________________________________。
③你认为此装置设计是否合理.科学?如不合理,请写出理由:___________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族有机物的分子式为C8H6O2,分子中除苯环外不含其它环状结构,则该分子中可能同时含有( )
A.羟基与碳碳叁键B.醛基与羟基C.酯基与碳碳双键D.羧基与甲基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯通入溴水中发生的化学反应方程式_______________________________________。实验室制取乙烯的化学反应方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量相等的硫酸铝和硫酸铵溶于水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,具有广泛的开发和应用前景。在体积可变的密闭容器中投入0.5molCO和1molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
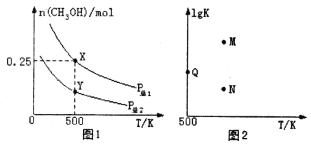
A.P总1<P总2
B.混合气体的密度不再发生变化,说明该反应已达到平衡状态
C.图2中M点能正确表示该反应平衡常数的对数(1gK)与温度的关系
D.若P总1=0.25MPa,则Y点的平衡常数Kp=64(MPa)-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com