
【题目】H、D、T 三种同位素具有不同的( )
A.质子数B.中子数C.核电荷数D.电子数
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】苯甲酸是常用的防腐剂和重要的医药原料。一种药用苯甲酸的制备方法如下:
Ⅰ.在反应罐中加入甲苯、饱和KMnO4溶液、Fe2O3(催化剂),加热、回流数小时,充分反应。
Ⅱ.反应结束后,改为蒸馏装置。加热蒸馏,直至冷凝管壁不再出现油珠。
Ⅲ.将反应罐中的混合物趁热过滤,滤渣用少量热水洗涤。
Ⅳ.向滤液中滴加浓盐酸酸化至pH=2,抽滤,用少量水洗涤,干燥得苯甲酸粗品。
Ⅴ.将粗苯甲酸加入……,结晶、洗涤、过滤,得到药用纯苯甲酸。
已知:相关物质的溶解度(g/mL)
温度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化钾 | 在乙醇中 | 难溶 | ||
(1)Ⅰ中发生的主要反应为:![]() (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。
(2)Ⅱ中蒸馏的目的是______。
(3)Ⅲ中趁热过滤的目的是______。
(4)将Ⅴ中操作补充完整:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSe 、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态Se原子的电子占据最高能级的电子云轮廓图为________形。
(2)向FeSe中嵌入吡啶(![]() )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________。
②液氨是氨气液化的产物,氨气易液化的原因是________。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________。
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室气体CO2资源化利用的一种途径如下,生成物H和I可用作锂离子电池的电解质。
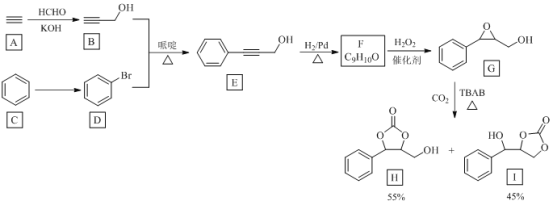
回答下列问题:
(1)由A到B的反应类型为________。
(2)由C到D反应所需试剂为________。
(3)E中官能团的名称是________。
(4)F合成G的反应方程式为________。
(5)H的分子式为________。
(6)写出与G互为同分异构体的羧酸类芳香化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为6:2:1:1)________。
(7)设计由丙炔和甲醛为起始原料制备 和
和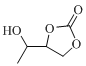 的合成路线 ____(无机试剂任选)。
的合成路线 ____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱碳:
向2L密闭容器中加入2mol CO2、8mol H2,在适当的催化剂作用下,发生反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
(1)该反应自发进行的条件是_______(填“低温”、“高温”或“任意温度”)
(2)下列叙述能说明此反应达到平衡状态的是_______________。
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数比为1﹕4
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有4mol H-H键断裂
Ⅱ.脱硝:
(3)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为__________。
(4)温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
甲 | 0.6 | 0 | 0 | 0.2 |
乙 | 0.3 | 0.5 | 0.2 | |
丙 | 0 | 0.5 | 0.35 | |
A.容器甲中发生反应的平衡常数为0.8
B.容器乙中起始时反应正向进行
C.达到平衡时,容器丙中c(O2)/c(NO2)>1
D.达到平衡时,容器甲与容器丙中的总压强之比为16∶17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是

A. A、B之间任意一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.lmol·L-1NH4HSO4溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是
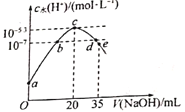
A. b点时,溶液的pH=7
B. 常温下,Kb(NH3·H2O)=1.0×10-5.3
C. Vd<30 mI
D. e点溶液中粒子浓度由大到小的顺序为c(Na+)>c(SO42-)>c(NH4+)>c(NH3·H2O )>c(OH- )>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是
A. pH=7
B. pH=3的盐酸与pH=11的氨水等体积混合后
C. 0.1mol/LNaOH溶液与0.05mol/LH2SO4溶液混合后
D. C(OH-)=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com