
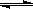 2/3Fe (s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����¡���
2/3Fe (s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����¡���
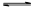 MOH+H+
MOH+H+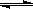 2/3Fe��s��+CO2��g��
2/3Fe��s��+CO2��g��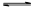 MOH+H+��
MOH+H+��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
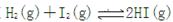 �ﵽƽ��״̬ʱ�ı�־��
�ﵽƽ��״̬ʱ�ı�־��| A��������������㶨���� |
| B������������ɫ���ٸı� |
| C�� H2��I2��HI��Ũ����� |
| D��I2��H2�����������ڻ�������е����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
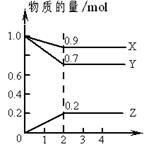
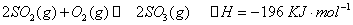 ʱ����2L�̶��ݻ����ܱ������г���2mol
ʱ����2L�̶��ݻ����ܱ������г���2mol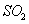 ��2mol
��2mol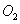 ��10���Ӻ�ﵽƽ�⣬
��10���Ӻ�ﵽƽ�⣬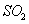 Ũ�Ⱥ�ʱ���ϵ��ͼ��
Ũ�Ⱥ�ʱ���ϵ��ͼ��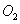 ��ƽ����Ӧ����Ϊ
��ƽ����Ӧ����Ϊ A��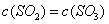 | B�����������ʵ������� |
C��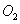 ��Ũ�ȱ��ֲ��� ��Ũ�ȱ��ֲ��� | D��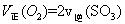 ) ) |
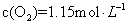 ������ͼ�ϻ���15-25����
������ͼ�ϻ���15-25����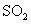 ��Ũ�ȱ仯���ߡ�
��Ũ�ȱ仯���ߡ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
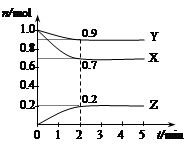
A����ѧ����ʽΪX(g)��3Y(g) 2Z(g) 2Z(g) |
B���ӷ�Ӧ��ʼ��2 min��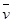 (X)��0.075 mol ��L-1�� min-1 (X)��0.075 mol ��L-1�� min-1 |
| C��2min��÷�Ӧ�ڴ��������Ѵﵽ��ѧƽ�� |
| D����X��Y��Z��Ϊ���壬��Ӧ��ƽ��ʱ��ѹǿ�ǿ�ʼʱ��0.9�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��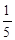 | B��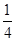 | C��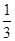 | D��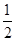 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����¶Ⱥ�ѹǿһ��ʱ����Ӧ�����ƽ�����������ٸı䣻 |
| B�����¶�һ��ʱ����λʱ��������2n mol XY��ͬʱ����n mol Y2�� |
| C�����¶�һ��ʱ��������ѹǿ����ʱ��ı䣻 |
| D�����¶�һ��ʱ���κ�ʱ����X2��Y2�����ʵ���֮��Ϊ��ֵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)��ƽ�⣬���ʼA��B�����ʵ����ֱ�ΪXmol��Ymol����Ҫʹƽ��ʱ��Ӧ�������ʵ����������������ʵ�����ȣ���X/YӦ�������
2C(g)��ƽ�⣬���ʼA��B�����ʵ����ֱ�ΪXmol��Ymol����Ҫʹƽ��ʱ��Ӧ�������ʵ����������������ʵ�����ȣ���X/YӦ������� �鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com