
工业上电解饱和食盐水可产生氯气,氯气与石灰乳反应可制得漂白粉。若欲制得标准状况112L氯气,则求理论上消耗多少克食盐?用这些氯气理论上可生产漂白粉多少克?
585克 635克
解析试题分析:电解饱和食盐水发生的反应为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,制得的氯气的物质的量为
2NaOH+H2↑+Cl2↑,制得的氯气的物质的量为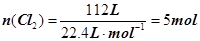 ,因为每生成1molCl2必消耗2molNaCl,所以消耗食盐的质量为
,因为每生成1molCl2必消耗2molNaCl,所以消耗食盐的质量为 ;氯气和Ca(OH)2反应可制得漂白粉(CaCl2和Ca(ClO)2的混合物):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,CaCl2 的摩尔质量为111 g·mol–1,Ca(ClO)2的摩尔质量为143g·mol–1,则可生产漂白粉:(111g·mol–1+143g·mol–1)×5mol×
;氯气和Ca(OH)2反应可制得漂白粉(CaCl2和Ca(ClO)2的混合物):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,CaCl2 的摩尔质量为111 g·mol–1,Ca(ClO)2的摩尔质量为143g·mol–1,则可生产漂白粉:(111g·mol–1+143g·mol–1)×5mol×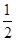 = 635g
= 635g
考点:考查物质的量在化学方程式计算中的应用。


科目:高中化学 来源: 题型:填空题
(1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式: 。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将足量CO2气体通过7.8gNa2O2固体。请回答:
(1)在标准状况下,生成氧气的体积为多少L。
(2)将上述反应后的固体配制成500 mL溶液,所得溶液物质的量浓度是多少mol/L。
(3)配制上述溶液时,以下操作会导致所配制溶液浓度偏低的有__________。
①转移溶液后没有洗涤烧杯和玻璃棒;②配制溶液时容量瓶中有少量水;
③在定容时,俯视刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将117 g NaCl溶于水配制成1 L溶液,回答下列问题:
(1)该溶液中NaCl的物质的量浓度为多少 ?
(2)配制1mol·L-1的NaCl溶液500mL,需要该溶液的体积为多少?
(3)向(2)所配制的溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3 mol·L- 1(假设溶液体积不变),则溶液中H+的物质的量浓度为多少?通入HCl气体的体积(标准状况下)为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把2.0 mol/L CuSO4溶液和1.0 mol/LH2SO4溶液各100 mL混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:
(1)混合液中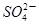 的物质的量浓度_____________mol/L;
的物质的量浓度_____________mol/L;
(2)向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余。此时,生成气体的体积(标准状况)为_________________L,溶液中Fe2+的物质的量浓度是___________mol/L;
(3)向混合溶液中滴加1 mol/L的NaOH溶液,使Cu2+恰好完全沉淀,所需NaOH溶液的体积_____________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫有多种化合物,许多含硫化合物在工业上有重要的用途。
(1)工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺。
3FeS2 + 12C+ 8O2  Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6S
A是 (写化学式)。若得到192克的硫磺,则产生标准状况下的A气体 L。
(2)硫的氯化物常做橡胶工业的硫化剂。硫与氯气在一定条件下反应,得到两种硫的氯化物B和D。B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32。计算确定这两种氯化物的分子式分别为 。
(3)硫化氢有毒。在120℃、101kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数。写出推导过程。(不考虑硫化氢的分解)
(4)硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得。取15.12g Na2SO3溶于80.0mL水中,加入5.00g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0mL,再冷却到10℃,则理论上析出Na2S2O3?5H2O多少克?写出推导过程。(已知:Na2S2O3的溶解度,10℃时为60.0g/100g水,100℃时为207g/100g水。100℃时,Na2S2O3饱和溶液的密度为1.14g/mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
Na2O2曾经是潜水艇或航天器中最理想的供氧剂。下表是人体呼出气体的成分(均为体积百分含最)。
| | 空气 成分 | 人体呼出 气体成分 |
| N2 | 78% | 74% |
| O2 | 21% | 16% |
| H2O | 0. 5% | 6% |
| CO2 | 0. 03% | 4% |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图6所示。请回答下列问题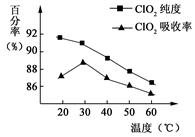
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol·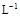 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·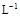 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=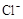 +5Fe3+ +2H2O
+5Fe3+ +2H2O
14H+ +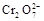 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com