
(1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式: 。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为 g。
(4分)(1)CaCO3(s)=CaO(s) + CO2(g) ΔH=+175.6kJ·mol-1 (2)4.16
解析试题分析:(1)10g CaCO3分解需要吸收17.56kJ 热量,则1mol即100g碳酸钙分解需要消耗的能量是175.6kJ,因此该反应的热化学方程式是CaCO3(s)=CaO(s) + CO2(g) ΔH=+175.6kJ·mol-1。
(2)碳酸氢钠分解的方程式是2NaHCO3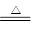 Na2CO3+H2O+CO2↑ △m↓
Na2CO3+H2O+CO2↑ △m↓
2×84g 106g 62g
m 0.31g
解得m=(62g×0.31g)÷168g=0.84g
所以原混合物中碳酸钠的质量为5.00g-0.84g=4.16g
考点:考查热化学方程式的书写、混合物的有关计算
点评:该题是基础性试题的考查,难度不大,有利于培养学生规范的答题能力,在计算碳酸钠的质量时,注意利用好差量法,注意有关解题方法的归纳和总结。


科目:高中化学 来源: 题型:填空题
将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题: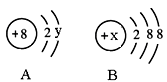
①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热: 。
(2)将CO2通入苯酚钠溶液中: 。
(3)1,3-丁二烯的与Br2的1、4加成反应: 。
(4)葡萄糖与银氨溶液发生银镜反应: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。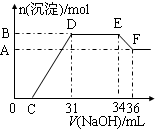
试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式: ,EF段生成含氧元素离子的名称是 。
(2)合金中,铝的质量为 g,铁的质量为 g 。
(3)C的值为 mL。
(4)硝酸溶液的物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取2.000g样品在空气中充分灼烧(假设杂质不参加反应),将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.3360mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液25.00mL。
已知:①4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
②SO2+2Fe3++2H2O→SO42-+2Fe2++4H+
③MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
(1)样品中FeS2的质量分数是 。(用小数表示,保留三位,下同)
(2)煅烧1000 t该黄铁矿生产出997.9 t硫酸铵,若黄铁矿制取硫酸时的利用率为0.800,则在制取硫酸铵时硫酸的利用率为 。
(3)为使黄铁矿充分燃烧,工业上使用过量空气(设空气中O2的体积分数为0.200),当空气过量20%时,煅烧后气体中SO2的体积分数是多少?
(4)若接触室导出的气体中含体积分数为0.0672的SO3。把出口气体送进吸收塔,用质量分数为0.980的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为0.200的SO3)。计算吸收106 m3出口气体(已折算为标准状况)所需要质量分数为0.980的硫酸的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4.0mol/L的氢氧化钠溶液35mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原溶液,加入0.96g铜粉共热,生成一氧化氮的体积为多少?
(3)另取10mL原溶液,加入1.92g铜粉共热,,至少还要向反应后的溶液中加入多少毫升1mol/L硫酸才能将铜粉恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4?5H2O。在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体。
(1)称取0.1000 g含有杂质的胆矾试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L硫酸滴定到终点,消耗硫酸10.08 mL,则试样中胆矾的质量分数为___________。
(已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;试样中的杂质不与酸、碱反应)
(2)将1.250 g纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960 g。剩余固体中结晶水的质量分数为__________(保留三位小数)。
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体。现将9.600 g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416 g。计算最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比。
(4)无水硫酸铜受热分解成氧化铜之前,有一种黄色中间产物X出现,其化学式可以表示为CuaOb(SO4)c(a、b、c为整数)。将X放入水中,有不溶的蓝色沉淀Y生成(化学式为CuSO4·nCu(OH)2),同时还有2/3的硫酸根溶于水。若对Y进行加热脱水,将失去11.9%的质量。已知X和Y均可溶于稀硫酸。通过计算确定X和Y的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业上电解饱和食盐水可产生氯气,氯气与石灰乳反应可制得漂白粉。若欲制得标准状况112L氯气,则求理论上消耗多少克食盐?用这些氯气理论上可生产漂白粉多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com