
有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4.0mol/L的氢氧化钠溶液35mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原溶液,加入0.96g铜粉共热,生成一氧化氮的体积为多少?
(3)另取10mL原溶液,加入1.92g铜粉共热,,至少还要向反应后的溶液中加入多少毫升1mol/L硫酸才能将铜粉恰好完全溶解?
(1)c(H2SO4)= 2mol/L c(HNO3)= 3mol/L
(2)标准状况下的体积V(NO)= 0.224L
(3)5×10-3L
解析试题分析:(1)20 mL混合液中含有n(SO42-)="9.32g÷233g/" mol="0.04" mol
n(H+)=35×10-3×4.0 mol / L ="0.14" mol
∴n((NO3-)="0.14" mol-2×0.04 mol =0.06mol
c(H2SO4)=0.04mol÷0.02L=2mol/L (1分)
c(HNO3)=0.06mol÷0.02L=3mol/L (1分)
(2) 10 mL混合液中含有n(H+)="0.07" mol,n(NO3-)=0.03mol
加入0.96g铜粉:n(Cu)=0.96g÷64g/mol=0.015mol
发生反应:3Cu + 8H++ 2NO3 - 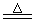 3Cu2+ + 2NO↑ + 4H2O
3Cu2+ + 2NO↑ + 4H2O
铜粉不足,生成NO:n(NO)=0.015mol×2÷3= 0.01 mol (1分)
标准状况下的体积V(NO)=" 0.01" mol×22.4 L / mol =0.224L (1分)
(3)10 mL混合液中含有n(H+)="0.07" mol,n((NO3-)=0.03mol
若加入1.92g铜粉:n(Cu)=1.92g÷64g/mol=0.03mol
发生反应:3Cu + 8H++ 2NO3 -  3Cu2+ + 2NO↑ + 4H2O
3Cu2+ + 2NO↑ + 4H2O
溶解1.92g铜粉至少需要n(H+)="0.08" mol ,n(NO3-)=0.02mol,显然H+不足(1分)
至少需要添加n(H+)="0.08" mol-0.07 mol="0.01" mol
∴ 至少加入稀硫酸:V(H2SO4)=0.01mol÷(2×1mol/L)=5×10-3L (2分)
答:略
考点:考查物质的量在化学反应方程式中的应用的相关知识点。


科目:高中化学 来源: 题型:填空题
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一块锌片插入足量CuSO4溶液1L中,可以观察到锌片表面有黄色附着物析出,最后称量时锌片质量减轻了0.1g(假设溶溶液体变化忽略不计),求:
(1)(1)参加反应的还原剂的物质的量是 ;
(2)还原产物的物质的量是 ;
(3)生成ZnSO4的物质的量浓度是 ;
(4)溶液的质量 ;(填“增加”或“减少”)
(5)写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知10g CaCO3分解需要吸收17.56kJ 热量,请写出碳酸钙分解的热化学反应方程式: 。
(2)加热5.00 g碳酸钠和碳酸氢钠的混合物,反应完成后混合物的质量减少了0.31 g,则原混合物中碳酸钠的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将3.25g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。
求:(1)反应中生成的H2在标准状况下的体积;
(2)所用盐酸中HCl的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
| 实验次数 | 称取样品的 质量/g | 所加Ba(OH)2 溶液的体积/L | 测得生成沉淀 的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将足量CO2气体通过7.8gNa2O2固体。请回答:
(1)在标准状况下,生成氧气的体积为多少L。
(2)将上述反应后的固体配制成500 mL溶液,所得溶液物质的量浓度是多少mol/L。
(3)配制上述溶液时,以下操作会导致所配制溶液浓度偏低的有__________。
①转移溶液后没有洗涤烧杯和玻璃棒;②配制溶液时容量瓶中有少量水;
③在定容时,俯视刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
Na2O2曾经是潜水艇或航天器中最理想的供氧剂。下表是人体呼出气体的成分(均为体积百分含最)。
| | 空气 成分 | 人体呼出 气体成分 |
| N2 | 78% | 74% |
| O2 | 21% | 16% |
| H2O | 0. 5% | 6% |
| CO2 | 0. 03% | 4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com