
有一块锌片插入足量CuSO4溶液1L中,可以观察到锌片表面有黄色附着物析出,最后称量时锌片质量减轻了0.1g(假设溶溶液体变化忽略不计),求:
(1)(1)参加反应的还原剂的物质的量是 ;
(2)还原产物的物质的量是 ;
(3)生成ZnSO4的物质的量浓度是 ;
(4)溶液的质量 ;(填“增加”或“减少”)
(5)写出该反应的离子方程式 。
(1)0.1 mol (2) 0.1 mol(3)0.1 mol/L(4)增加 (5)Zn + Cu2+ = Zn2+ + Cu
解析试题分析:锌片插入足量CuSO4溶液发生反应为:Zn+CuSO4=ZnSO4+Cu。锌是还原剂,CuSO4是氧化剂,ZnSO4还原产物,Cu是还原产物。根据方程式可得每有1mol锌即65克参加反应就生成64克铜,对固体来说质量减少;对溶液来说质量增加。这时固体质量减少1克,现在质量减少0.1克,所以参加反应的还原剂锌的物质的量是0.1摩尔,C(ZnSO4)=0.1mol/1L=0.1 mol/L.该反应的离子方程式是:)Zn + Cu2+ = Zn2+ + Cu。
考点:考查离子反应方程式的书写及氧化还原反应的有关概念及相应的化学计算等的知识。


科目:高中化学 来源: 题型:填空题
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率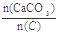 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(3)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率 为何值?
为何值?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验需要0.10mol/LNaOH溶液470mL,根据溶液配制中情况回答下列问题:
(1)实验中除了托盘天平、烧杯、玻璃棒、量筒、药匙外还需要的其它仪器有: 。
(2)根据计算得知,所需NaOH的质量为 g。
(3)定容时,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是 。
(4)定容时,若加入的水超过刻度线,必须采取的措施是: 。
(5)下列操作对所配浓度有何影响(填写字母)
偏低的有 ;无影响的有 。
| A.称量用了生锈的砝码; |
| B.将NaOH放在纸张上称量; |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中; |
| D.定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题: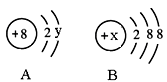
①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制时必须的玻璃仪器有:烧杯、玻璃棒、 、 。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)下列配制的溶液浓度偏低的是 ;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水
(4)某同学改用固体Na2CO3配制Na2CO3溶液的过程如图所示,其错误操作序号是 

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热: 。
(2)将CO2通入苯酚钠溶液中: 。
(3)1,3-丁二烯的与Br2的1、4加成反应: 。
(4)葡萄糖与银氨溶液发生银镜反应: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。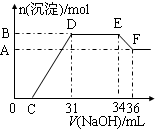
试回答下列问题:
(1)写出反应过程中DE段的离子反应方程式: ,EF段生成含氧元素离子的名称是 。
(2)合金中,铝的质量为 g,铁的质量为 g 。
(3)C的值为 mL。
(4)硝酸溶液的物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4.0mol/L的氢氧化钠溶液35mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原溶液,加入0.96g铜粉共热,生成一氧化氮的体积为多少?
(3)另取10mL原溶液,加入1.92g铜粉共热,,至少还要向反应后的溶液中加入多少毫升1mol/L硫酸才能将铜粉恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业上通过电解饱和的食盐水来制取氯气。现取100mL含NaCl为11.7g的饱和食盐水进行电解,
(1)写出电解饱和食盐水制取氯气的化学方程式
(2)在标准状况下制得Cl2多少升?
(3)所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com