
【题目】下列叙述正确的是( )
①0.1molL﹣1氨水中,c(OH﹣)=c(NH4+)
②10mL 0.02 molL﹣1 HCl溶液与10mL 0.02 molL﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
③在0.1 molL﹣1CH3COONa溶液中,c(OH﹣)=c(CH3COOH)+c(H+)
④0.1 molL﹣1某二元弱酸的强碱盐NaHA溶液中,c(Na+)=2c(A2﹣)+c(HA﹣)+c(H2A)
A.①②③B.②③C.②③④D.①④
【答案】B
【解析】
①0.1 mol·L1氨水中,一水合氨电离和水电离,因此c(OH-)> c(NH4+),故①错误;10mL 0.02 mol·L1 HCl溶液与10mL 0.02 mol·L1Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,溶液显碱性,只反应了一半的Ba(OH)2溶液,则溶液中![]() ,
,![]() ,则溶液的pH=12,故②正确;③在0.1 mol·L1CH3COONa溶液中,根据质子守恒得到c(OH-)=c(CH3COOH)+c(H+),故③正确;④0.1 mol·L1某二元弱酸的强碱盐NaHA溶液中,根据物料守恒得到c(Na+)=c(A2)+c(HA-)+c(H2A),故④错误;因此②③正确,故B正确。
,则溶液的pH=12,故②正确;③在0.1 mol·L1CH3COONa溶液中,根据质子守恒得到c(OH-)=c(CH3COOH)+c(H+),故③正确;④0.1 mol·L1某二元弱酸的强碱盐NaHA溶液中,根据物料守恒得到c(Na+)=c(A2)+c(HA-)+c(H2A),故④错误;因此②③正确,故B正确。
综上所述,答案为B。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是 ( )
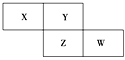
A. 原子半径:W>Z>XB. 非金属性:Z>Y
C. 最高化合价:X>ZD. 最高价氧化物对应水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.含氮化合物在工农业生产中都有重要应用。
(1)氨和肼(N2H4)是两种最常见的氮氢化物。
己知:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g)N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为___________,该反应的化学平衡常数K=__________(用K1、K2表示)。
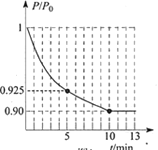
(2)对于2NO(g)+2CO(g)N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是____________(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆 D.容器中混合气体的平均摩尔质量不变
②图为容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)= _____________,平衡时NO的转化率为______________。(已知气体的压强比等于其物质的量之比)
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式________________。
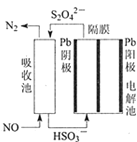
Ⅱ.采用氨水吸收烟气中的 SO2
若氨水与 SO2恰好完全反应生成正盐,则此时溶液呈_________性(填“酸”或“碱”)。 常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10-5molLˉ1;H2SO3 : Ka1=1.3×10-2molLˉ1,Ka2=6.3×10-8molLˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是

A.图中的甲池为电解池,乙池为原电池
B.a极发生的电极反应为SO2-2e-+2H2O===SO42-+4H+
C.N2O5在c极上产生,c极的电极反应为N2O4-2e-+H2O===N2O5+2H+
D.当消耗标况下2.24 L SO2时,若要维持硫酸的浓度不变则应补充水11.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
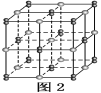
【题目】已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大。其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子。D、E为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。E的d能级电子数等于A、B、C最高能层的p能级电子数之和。
回答下列问题:
(1)五种元素中,电负性最大的是________(填元素符号)。
(2)E常有+2、+3两种价态,画出E2+的价电子排布图:________________。
(3)与BC互为等电子体的分子、离子分别是______________________(各举1例),BC的结构式为______________(若有配位键,须用“→”表示出来),实验测得该分子的极性极弱,试从结构方面进行解释:________________________________________________。
(4)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7·10H2O,实际上它的结构单元是由2个H3AO3和2个[A(OH)4]-缩合而成的双六元环,应该写成Na2[A4O5(OH)4]·8H2O,其结构式如图1所示,它的阴离子可形成链状结构。
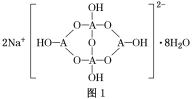
①A原子的杂化方式为________。
②Na2[A4O5(OH)4]·8H2O的阴离子由极性键和配位键构成,请在图中用“→”标出其中的配位键________。该阴离子通过________________相互结合形成链状结构。
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因:________________________________________________________________________。
(5)E2+在水溶液中以[E(H2O)6]2+形式存在,向含E2+的溶液中加入氨水,可生成[E(NH3)6]2+,[E(NH3)6]2+更稳定,原因是_____________________________。
(6)由元素B、D组成的某离子化合物的晶胞结构如图2所示,则该物质的电子式为_____。若晶胞的长、宽、高分别为520 pm、520 pm和690 pm,该晶体的密度为________(保留小数点后两位数字)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合成有机光电材料的中间体,结构简式如图所示。下列说法正确的是
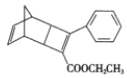
A.属于芳香烃B.分子式为C18H16O2
C.苯环上的二氯取代物有6种D.性质稳定,不与强酸、强碱、强氧化剂反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢作为氢能利用的关键技术,是当前关注的热点之一。一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法错误的是( )
已知:电流效率(η=![]() ×100%)
×100%)
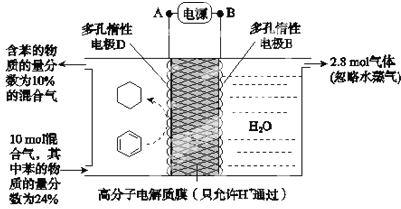
A.电源B为正极
B.导线中电子移动方向为A→D
C.电极D反应式为C6H6+6H++6e-=C6H12
D.该储氢装置的电流效率η=24.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
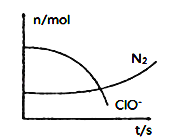
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
查看答案和解析>>
科目:高中化学 来源: 题型:
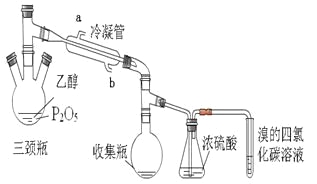
【题目】有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
实验 | P2O5 | 95%乙醇量 | 加热方式 |
实验1 | 2g | 4mL | 酒精灯 |
实验2 | 2g | 4mL | 水浴70℃ |
实验结果如下:
实验 | 实验现象 | ||
三颈瓶 | 收集瓶 | 试管 | |
实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 | 有无色液体 | 溶液褪色 |
实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
根据上述资料,完成下列填空。
(1)写出乙醇制乙烯的化学方程式______________________________________。
(2)上图装置中冷凝管的作用是___________,进水口为(填“a”或“b”)______,浓硫酸的作用是_____________。
(3)实验1使溴的四氯化碳溶液褪色的物质是___________。
(4)实验2中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式
_____________________,P2O5在实验1中的作用是______________________ 。
(6)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是____________
②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com