
【题目】已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大。其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子。D、E为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。E的d能级电子数等于A、B、C最高能层的p能级电子数之和。
回答下列问题:
(1)五种元素中,电负性最大的是________(填元素符号)。
(2)E常有+2、+3两种价态,画出E2+的价电子排布图:________________。
(3)与BC互为等电子体的分子、离子分别是______________________(各举1例),BC的结构式为______________(若有配位键,须用“→”表示出来),实验测得该分子的极性极弱,试从结构方面进行解释:________________________________________________。
(4)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7·10H2O,实际上它的结构单元是由2个H3AO3和2个[A(OH)4]-缩合而成的双六元环,应该写成Na2[A4O5(OH)4]·8H2O,其结构式如图1所示,它的阴离子可形成链状结构。
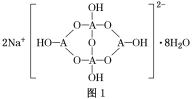
①A原子的杂化方式为________。
②Na2[A4O5(OH)4]·8H2O的阴离子由极性键和配位键构成,请在图中用“→”标出其中的配位键________。该阴离子通过________________相互结合形成链状结构。
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因:________________________________________________________________________。
(5)E2+在水溶液中以[E(H2O)6]2+形式存在,向含E2+的溶液中加入氨水,可生成[E(NH3)6]2+,[E(NH3)6]2+更稳定,原因是_____________________________。
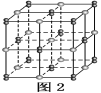
(6)由元素B、D组成的某离子化合物的晶胞结构如图2所示,则该物质的电子式为_____。若晶胞的长、宽、高分别为520 pm、520 pm和690 pm,该晶体的密度为________(保留小数点后两位数字)g·cm-3。
【答案】O ![]() N2、CN-(其他合理答案均可)
N2、CN-(其他合理答案均可) ![]() 分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性 sp2和sp3
分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性 sp2和sp3 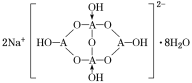 氢键 H3BO3+H2O=[B(OH)4]-+H+{或B(OH)3+H2O=[B(OH)4]-+H+} N的电负性小于O,N原子更易提供孤对电子形成配位键 Ca2+[
氢键 H3BO3+H2O=[B(OH)4]-+H+{或B(OH)3+H2O=[B(OH)4]-+H+} N的电负性小于O,N原子更易提供孤对电子形成配位键 Ca2+[![]() ]2- 2.28
]2- 2.28
【解析】
A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大。其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns2np2、ns2np4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Co,据此分析计算。
根据上述分析,A为B元素、B为C元素、C为O元素,D为Ca元素,E为Co元素。
(1)非金属性越强,电负性越大,同周期自左而右,电负性增大,五种元素中,O元素电负性最大,故答案为:O;
(2)E为Co,常有+2、+3两种价态,Co2+离子的价电子排布图![]() ,故答案为:
,故答案为:![]() ;
;
(3)与CO互为等电子体的分子、离子分别是N2、CN-,CO的结构式为![]() ,分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性,使得该分子的极性极弱,故答案为:N2、CN-;
,分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性,使得该分子的极性极弱,故答案为:N2、CN-;![]() ;分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性;
;分子中氧原子提供孤对电子形成配位键抵消了共价键的共用电子对偏向氧原子产生的极性;
(4)①A为B元素,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键,杂化轨道类型为sp2、sp3,故答案为:sp2、sp3;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键,图1中用“→”标出其中的配位键为: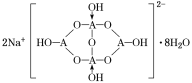 ,该阴离子通过氢键相互结合形成链状结构,故答案为:
,该阴离子通过氢键相互结合形成链状结构,故答案为: ;氢键;
;氢键;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子,用离子方程式表示为H3BO3+H2O[B(OH)4]-+H+,故答案为:H3BO3+H2O[B(OH)4]-+H+;
(5)Co2+离子在水溶液中以[Co(H2O)6]2+形式存在,向含Co2+离子的溶液中加入氨水,可生成更稳定的
(6) 晶胞中钙离子、C22-数目相等,都为8×![]() +6×
+6×![]() =4,形成的离子化合物为CaC2,电子式为
=4,形成的离子化合物为CaC2,电子式为![]() ;晶胞质量为4×
;晶胞质量为4×![]() g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为
g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为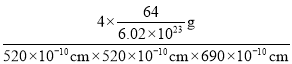 =2.28g/cm3,故答案为:
=2.28g/cm3,故答案为:![]() ;2.28。
;2.28。


科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
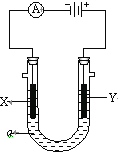
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为___;在X极附近观察到的实验现象是___;
②电解总反应的离子方程式:____。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___;电极反应式是___。
②Y电极的材料是___;电极反应式是___。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
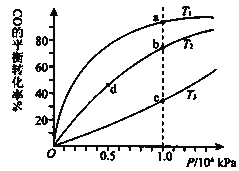
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①0.1molL﹣1氨水中,c(OH﹣)=c(NH4+)
②10mL 0.02 molL﹣1 HCl溶液与10mL 0.02 molL﹣1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
③在0.1 molL﹣1CH3COONa溶液中,c(OH﹣)=c(CH3COOH)+c(H+)
④0.1 molL﹣1某二元弱酸的强碱盐NaHA溶液中,c(Na+)=2c(A2﹣)+c(HA﹣)+c(H2A)
A.①②③B.②③C.②③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)的主要用途是制造特种钢,用CO还原MoO3(白色粉末,加热时变黄)制备单质Mo的装置如图。下列说法正确的是

A.装置②中盛有饱和Na2CO3溶液,装置③中盛有浓硫酸,作用是净化CO2
B.装置①中的稀盐酸可用稀硫酸代替,石灰石可用碳酸钠粉末代替
C.装置④的作用是制备CO,装置⑤的作用是CO还原MoO3
D.装置⑥能达到检验MoO3是否被CO还原的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法正确的是( )
A.二氧化硫可用作葡萄酒的食品添加剂
B.漂白粉长期放置在空气中会被空气中的氧气氧化而变质
C.通讯领域中的光导纤维可长期浸泡在强碱性溶液中
D.汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如图所示,下列说法中不正确的是

A.上述反应为氧化还原反应
B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶使反应充分
D.脱氢维生素C的分子式为C6H6O6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com