
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
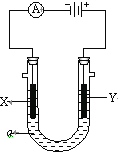
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为___;在X极附近观察到的实验现象是___;
②电解总反应的离子方程式:____。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___;电极反应式是___。
②Y电极的材料是___;电极反应式是___。
(说明:杂质发生的电极反应不必写出)
【答案】2Cl-﹣2e-=Cl2↑ 放出气体、溶液变红色 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 精铜 Cu2++2e-=Cu 粗铜 Cu-2e-=Cu2+
Cl2↑+H2↑+2OH- 精铜 Cu2++2e-=Cu 粗铜 Cu-2e-=Cu2+
【解析】
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,Y电极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验,X电极上氢离子放电,同时该电极附近生成氢氧根离子;
(2)根据电解精炼铜的工作原理知识来回答。
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红;
①Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑;
②X电极上氢离子放电,同时该电极附近生成氢氧根离子,Y电极上氯离子放电生成氯气,所以电池反应式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)①电解方法精炼粗铜,电解池的阴极材料是精铜,电极反应为:Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+。


科目:高中化学 来源: 题型:
【题目】(1)写出COS的电子式__________________,C与O形成共价键时,共用电子对会偏向__________原子,判断依据是___________。
(2)已知COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/mol
CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol
写出H2S与CO反应生成COS的热化学方程式__________________________________。
100℃时将CO与H2S按物质的量比为1∶1充入反应器中,达平衡后CO的转化率α=33.3%,此时反应的平衡常数k=________________________。
(3)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
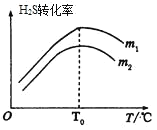
①m1________m2(填>、<或=)
②温度高于T0时,H2S转化率减小的可能原因为_________
a.反应停止了 b.反应的△H变大
c.反应达到平衡 d.催化剂活性降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一.种重要的化工原料,在农业、电化学和建筑等领域均有广泛应用。以含锰废料(含有MnO2 、CuO、Fe和少量CaO)为原料制备MnSO4的一种流程如下:
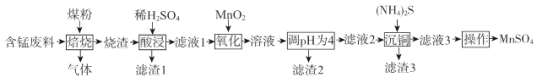 已知:
已知:
I .烧渣中含有MnO、CuO、Cu、Fe、CaO。
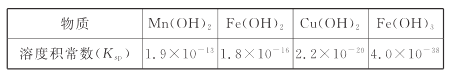
II.难溶电解质的溶度积常数如下表所示:
回答下列问题:
(1)“焙烧”过程加入煤粉的主要作用为___________________________。
(2)“酸浸”时所加稀H2SO4不宜过量太多的原因为______________________________.滤渣1的主要成分为_____________________(填化学式)。
(3)“氧化”过程中主要反应的离子方程式为__________________。
(4)“调pH为4”的目的为______________________;若“溶液”中c(Cu2+ )=0.022 mol/L,“滤液2”的体积是“溶液”体积的2倍,则“调pH为4”时Cu2+是否开始沉淀____________(通过计算说明)。
(5)(NH4)2S的电子式为___________________。
(6)已知:(NH4)2SO4与MnSO4的溶解度曲线如图所示。“操作”主要包括蒸发浓缩_______、过滤 、洗涤、干燥;其中用乙醇代替水洗涤的原因为__________,需控制温度为____( 填选项字母)得到产品最多。
A.10°C B.40 °C C.60 °C D.100°C
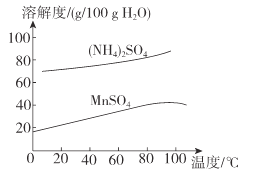
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)和氨均为重要的化工原料。回答下列问题:
已知:I.N2H4(l)+O2(g)![]() N2(g)+2H2O(l) △H=-624.0 kJ/mol
N2(g)+2H2O(l) △H=-624.0 kJ/mol
II.N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
III.2NH3(g)![]() N2H4(l)+H2(g) △H=+144.8 kJ/mol
N2H4(l)+H2(g) △H=+144.8 kJ/mol
(1)H2的燃烧热△H=_____________。
(2)T1 °C时,向恒容的密闭容器中加入1 mol N2H4和1 mol O2,发生反应I。达到平衡后,只改变下列条件,能使N2的平衡体积分数增大的是_______( 填选项字母)。
A.增大压强 B.再通入一定量O2
C.分离出部分水 D.降低温度
(3)在恒压绝热的密闭容器中通入一定量的N2和H2,发生反应II和反应III。反应III对N2的平衡转化率的影响为_____(填“增大”“减小”或“无影响”),理由为___________。
(4)t2°C时,向刚性容器中充入NH3,发生反应III。NH3和H2的分压(p)与时间(t)的关系如图所示。
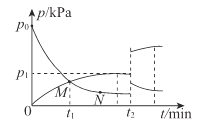
①0~t1min内,反应的平均速率v(NH3)=____kPa/min
②反应的平衡常数Kp=______kPa-1 (Kp为用分压表示的平衡常数)。
③反应物分子的有效碰撞几率:M____N(填“>”“<”或“=”)。
④t2 min时升高温度,再次达到平衡后,H2的分压增大的原因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸___。
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2___(选填“是”或“否”).混合液中离子浓度c(A-)与c(Na+)的大小关系是___。
(3)丙组实验结果分析,HA是___酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=___molL-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是 ( )
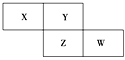
A. 原子半径:W>Z>XB. 非金属性:Z>Y
C. 最高化合价:X>ZD. 最高价氧化物对应水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验 Na2O2试样是否变质为 Na2CO3:向试样中加入盐酸,产生无色无味的气体
B.检验某卤代烃是否是氯代烃: 试样 ![]() 冷却
冷却![]()
![]() 出现白色沉淀
出现白色沉淀
C.除去溴乙烷中混有的溴:混合液![]()
![]() 溶液分层
溶液分层![]() 得下层
得下层
D.鉴定盐 A 的成分是 FeBr2:
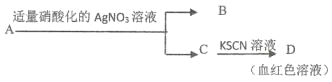
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
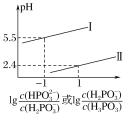
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg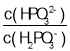 的是曲线_____(填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____,反应HPO32-+H2O
的是曲线_____(填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____,反应HPO32-+H2O![]() H2PO3-+OH-的平衡常数的值是_____。
H2PO3-+OH-的平衡常数的值是_____。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大。其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子。D、E为同周期元素且分别位于s区和d区。五种元素所有的s能级电子均为全充满。E的d能级电子数等于A、B、C最高能层的p能级电子数之和。
回答下列问题:
(1)五种元素中,电负性最大的是________(填元素符号)。
(2)E常有+2、+3两种价态,画出E2+的价电子排布图:________________。
(3)与BC互为等电子体的分子、离子分别是______________________(各举1例),BC的结构式为______________(若有配位键,须用“→”表示出来),实验测得该分子的极性极弱,试从结构方面进行解释:________________________________________________。
(4)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7·10H2O,实际上它的结构单元是由2个H3AO3和2个[A(OH)4]-缩合而成的双六元环,应该写成Na2[A4O5(OH)4]·8H2O,其结构式如图1所示,它的阴离子可形成链状结构。
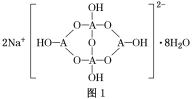
①A原子的杂化方式为________。
②Na2[A4O5(OH)4]·8H2O的阴离子由极性键和配位键构成,请在图中用“→”标出其中的配位键________。该阴离子通过________________相互结合形成链状结构。
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因:________________________________________________________________________。
(5)E2+在水溶液中以[E(H2O)6]2+形式存在,向含E2+的溶液中加入氨水,可生成[E(NH3)6]2+,[E(NH3)6]2+更稳定,原因是_____________________________。
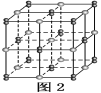
(6)由元素B、D组成的某离子化合物的晶胞结构如图2所示,则该物质的电子式为_____。若晶胞的长、宽、高分别为520 pm、520 pm和690 pm,该晶体的密度为________(保留小数点后两位数字)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com