
【题目】三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
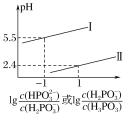
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg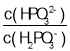 的是曲线_____(填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____,反应HPO32-+H2O
的是曲线_____(填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____,反应HPO32-+H2O![]() H2PO3-+OH-的平衡常数的值是_____。
H2PO3-+OH-的平衡常数的值是_____。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)![]()
【答案】PCl3+H2O+Cl2![]() POCl3+2HCl c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+) Ⅰ 10-1.4 10-7.5 4×10-7
POCl3+2HCl c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+) Ⅰ 10-1.4 10-7.5 4×10-7
【解析】
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,三氯氧磷为POCl3,实际上为PCl3与Cl2反应生成PCl5,PCl5水解生成POCl3;
(2)亚磷酸(H3PO3)为二元弱酸,则HPO32-不能再发生电离,只能水解,使溶液呈碱性,据此分析;
(3)根据H3PO3的电离平衡常数,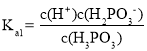 ,
,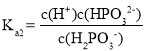 ,则
,则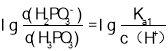 ,
,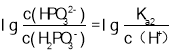 所以图象关系可表示为:pH=
所以图象关系可表示为:pH=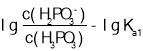 ,pH=
,pH=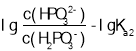 ,据此分析;
,据此分析;
(4)根据CaSO4的溶度积常数计算。
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,三氯氧磷为POCl3,实际上为PCl3与Cl2反应生成PCl5,PCl5水解生成POCl3,发生的化学反应为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)亚磷酸(H3PO3)为二元弱酸,则HPO32-不能再发生电离,只能水解,使溶液呈碱性,同时考虑到水也存在电离平衡,所以溶液中c(H2PO3-)<c(OH-),因此溶液中离子浓度大小顺序为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+),故答案为:c(Na+)>c(HPO32-)>c(OH-)>c(H2PO3-)>c(H+);
(3)根据H3PO3的电离平衡常数,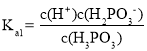 ,
,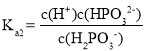 ,则
,则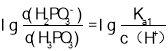 ,
,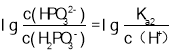 所以图象关系可表示为:pH=
所以图象关系可表示为:pH=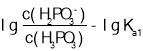 ,pH=
,pH=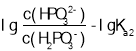 ,由于Ka1>Ka2,所以表示
,由于Ka1>Ka2,所以表示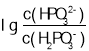 的图形,纵截距更大,根据图像,则表示
的图形,纵截距更大,根据图像,则表示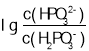 的图线为曲线Ⅰ,当溶液中
的图线为曲线Ⅰ,当溶液中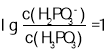 时,pH=2.4,所以
时,pH=2.4,所以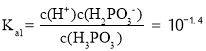 ,反应
,反应![]() 的平衡常数
的平衡常数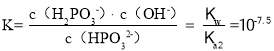 ,故答案为:Ⅰ;10-1.4;10-7.5;
,故答案为:Ⅰ;10-1.4;10-7.5;
(4))处理后的废水中c(Ca2+)=5×10-6mol/L,则溶液中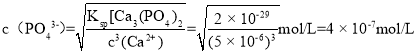 ,故答案为:4×10-7。
,故答案为:4×10-7。


科目:高中化学 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:下列叙述正确的是
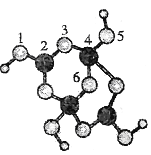
A.Xm-的化学式为B4O8H42-
B.硼原子轨道的杂化类型有sp2、 sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、配位键两种化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
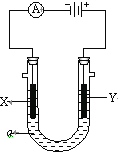
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为___;在X极附近观察到的实验现象是___;
②电解总反应的离子方程式:____。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___;电极反应式是___。
②Y电极的材料是___;电极反应式是___。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度均为0.1 mol·L-1的NaOH溶液和盐酸分别滴定体积均为20 mL浓度均为0.1 mol·L-1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是( )
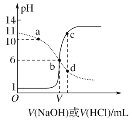
A.HA为弱酸,BOH为强碱
B.a点时,溶液中粒子浓度存在关系:c(BOH)<c(B+)
C.b点时V=20
D.c、d两点溶液混合后微粒之间存在关系:c(H+)=c(OH-)+c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=![]() ]与混合液pH的关系如图所示。下列说法正确的是( )
]与混合液pH的关系如图所示。下列说法正确的是( )

A.f=0时,溶液中:c(Na+)=2c(![]() )
)
B.f=0.5时,溶液中:c(![]() )>c(
)>c(![]() )
)
C.f=1时,溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.f=2时,溶液中:![]() c(Na+)=c(
c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸苯乙酯的反应如图:
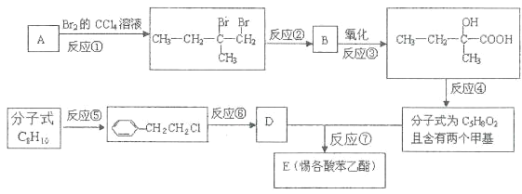
(1)写出物质B的分子式:_____。
(2)写出反应类型:反应①:_____反应;反应⑥:_____反应。
(3)写出反应试剂和反应条件:反应②_____;反应⑤_____。
(4)写出化学反应方程式:反应④_____;反应⑦_____。
(5)如何检验 中的溴元素?_____。
中的溴元素?_____。
(6)写出符合下列条件惕格酸的同分异构体的结构简式:_____。条件:与惕格酸含相同官能团,且也有两个甲基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法正确的是( )
A.二氧化硫可用作葡萄酒的食品添加剂
B.漂白粉长期放置在空气中会被空气中的氧气氧化而变质
C.通讯领域中的光导纤维可长期浸泡在强碱性溶液中
D.汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com