
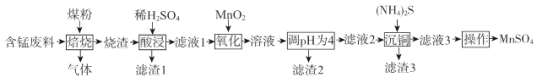
【题目】硫酸锰是一.种重要的化工原料,在农业、电化学和建筑等领域均有广泛应用。以含锰废料(含有MnO2 、CuO、Fe和少量CaO)为原料制备MnSO4的一种流程如下:
 已知:
已知:
I .烧渣中含有MnO、CuO、Cu、Fe、CaO。
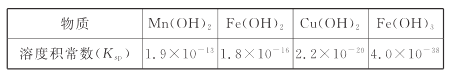
II.难溶电解质的溶度积常数如下表所示:
回答下列问题:
(1)“焙烧”过程加入煤粉的主要作用为___________________________。
(2)“酸浸”时所加稀H2SO4不宜过量太多的原因为______________________________.滤渣1的主要成分为_____________________(填化学式)。
(3)“氧化”过程中主要反应的离子方程式为__________________。
(4)“调pH为4”的目的为______________________;若“溶液”中c(Cu2+ )=0.022 mol/L,“滤液2”的体积是“溶液”体积的2倍,则“调pH为4”时Cu2+是否开始沉淀____________(通过计算说明)。
(5)(NH4)2S的电子式为___________________。
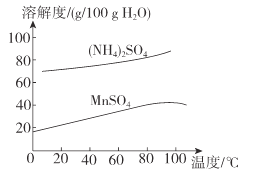
(6)已知:(NH4)2SO4与MnSO4的溶解度曲线如图所示。“操作”主要包括蒸发浓缩_______、过滤 、洗涤、干燥;其中用乙醇代替水洗涤的原因为__________,需控制温度为____( 填选项字母)得到产品最多。
A.10°C B.40 °C C.60 °C D.100°C
【答案】作还原剂 避免“调pH为4”时会消耗过多的碱 CaSO4、Cu MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 将Fe3+转化为Fe(OH)3沉淀过滤除去 滤液2中c(Cu2+)=0.011 mol/L,c(OH-)=1×10-10 mol/L,则Qc[Cu(OH)2]=0.11×(1×10-10)2=1.1×10-22<Ksp c[Cu(OH)2],所以Cu2+未开始形成沉淀  降温结晶 减少因溶解而造成的损失,且乙醇挥发带走水分,便于干燥 A
降温结晶 减少因溶解而造成的损失,且乙醇挥发带走水分,便于干燥 A
【解析】
含锰废料与煤粉在高温下混合,其中MnO2与C反应产生MnO,CuO与C反应产生Cu单质,同时得到含有CO的气体,得到的烧渣中含有MnO、CuO、Cu、Fe、CaO,然后同稀硫酸酸浸,其中MnO、CuO、Fe反应变为Mn2+、Cu2+、Fe2+,CaO反应产生溶解度较小的CaSO4进入滤渣1中,而Cu不能溶解,进入滤渣1,向滤液1中加入MnO2,可在酸性条件下氧化Fe2+为Fe3+,然后调节溶液的pH=4,可以使Fe3+转化为Fe(OH)3沉淀过滤除去,滤渣2成分为Fe(OH)3,向滤液2中加入(NH4)2S,其电离产生的S2-与溶液中Cu2+形成CuS沉淀过滤出去,进入滤渣3中,滤液3中含有的Mn2+、SO42-、NH4+等,根据溶解度曲线可知从滤液3中提取MnSO4采用的操作过程为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到MnSO4,结合乙醇易挥发,会带走水分,便于干燥,结合温度对物质溶解度的影响分析温度控制范围。
(1)由流程中物质转化关系可知在焙烧时加入煤粉可以与MnO2反应转化为MnO,因此煤粉的作用是作还原剂;
(2)“酸浸”时所加稀H2SO4不宜过量太多的原因是若过多,调节pH=4时就会消耗过多的碱,由信息可知加入稀硫酸可将CaO转化为CaSO4,同时焙烧时CuO转化为Cu不溶于稀硫酸,故滤渣1的主要成分是CaSO4和Cu;
(3)“氧化”过程中MnO2在酸性条件下将Fe2+氧化为Fe3+,主要反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)“调pH为4”的目的是将Fe3+转化为Fe(OH)3沉淀过滤除去。滤液2的体积是溶液体积的2倍,则滤液2中c(Cu2+)=0.011 mol/L,c(OH-)=![]() mol/L=1×10-10 mol/L,则Qc[Cu(OH)2]=0.011×(1×10-10)2=1.1×10-22<Ksp c[Cu(OH)2],所以Cu2+未开始形成沉淀;
mol/L=1×10-10 mol/L,则Qc[Cu(OH)2]=0.011×(1×10-10)2=1.1×10-22<Ksp c[Cu(OH)2],所以Cu2+未开始形成沉淀;
(5)(NH4)2S是离子化合物,由NH4+与S2-通过离子键结合而成,其电子式为 ;
;
(6)由溶解度曲线可知:从滤液3中提取MnSO4的操作主要包括蒸发浓缩、降温结晶、过滤、洗涤、干燥。MnSO4易溶于水,用乙醇代替水洗涤就可以减少因溶解而造成的损失,且乙醇易挥发带走水分,便于干燥,根据溶解度曲线可知温度可知在10℃时所得产品最多,故合理选项是A。


科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水:C1-+2H2O![]() H2↑+Cl2↑+OH-
H2↑+Cl2↑+OH-
B.铅蓄电池充电时阳极反应式为:PbSO4–2e-+2H2O=PbO2+4H++SO42―
C.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH-
D.钢铁发生电化学腐蚀的正极反应式:Fe–2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:下列叙述正确的是
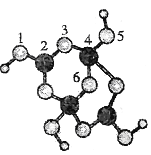
A.Xm-的化学式为B4O8H42-
B.硼原子轨道的杂化类型有sp2、 sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、配位键两种化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某项目小组同学发现某一种胃药片的止酸剂为碳酸钙,为了测定其中止酸剂的质量特制定了如下操作步骤:
①配制0.2mol·L-1的HCl溶液和0.2mol·L-1的NaOH溶液;②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后放入锥形瓶中再加入20mL蒸馏水;③以酚酞作指示剂,用0.2mol·L-1的NaOH溶液滴定,需用去VmL达滴定终点;④加入25mL0.2mol·L-1的HCl溶液。
(1)写出全部实验过程的操作步骤的顺序:__。
(2)如图所示的仪器中配制0.2mol·L-1的HCl溶液和0.2mol·L-1NaOH溶液肯定不需要的仪器是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。

(3)配制上述溶液应选用的容量瓶的规格分别为__(填字母)。
A.50mL、50mL B.100mL、100mL
C.100mL、150mL D.250mL、250mL
(4)配制过程中,下列情况会使配制结果偏高的是__(填序号)。
A.洗净后容量瓶内还残留蒸馏水未烘干
B.量取浓盐酸时,仰视刻度线观察液面
C.定容时,仰视刻度线
D.定容后,加盖倒转摇匀后,发现液面低于刻度线又加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,下列关于实验现象的描述正确的是( )
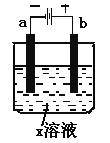
a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:可能用到的数据信息和装置如下。
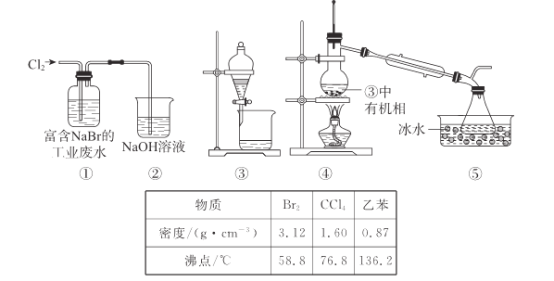
下列说法错误的是
A.实验时,①的废水中出现红色
B.②的作用是吸收尾气,防止空气污染
C.用③进行萃取时,选择CCl4比乙苯更合理
D.④中温度计水银球低于支管过多,导致Br2的产率低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
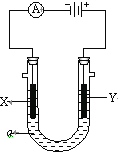
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①Y电极上的电极反应式为___;在X极附近观察到的实验现象是___;
②电解总反应的离子方程式:____。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___;电极反应式是___。
②Y电极的材料是___;电极反应式是___。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com