
【题目】实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:可能用到的数据信息和装置如下。
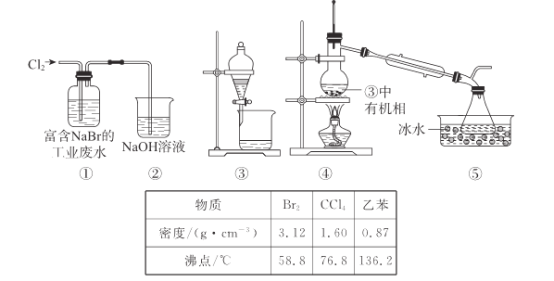
下列说法错误的是
A.实验时,①的废水中出现红色
B.②的作用是吸收尾气,防止空气污染
C.用③进行萃取时,选择CCl4比乙苯更合理
D.④中温度计水银球低于支管过多,导致Br2的产率低
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】铜是重要的贵重金属,其化合物在催化剂研究和光电材料等方面应用广泛。回答下列问题:
(1)在铜的配合物中,H2O、NH3、CO等常用作配体。
①基态Cu2+的价电子轨道表示式为_________。
②H、C、N、O元素中,元素的第一电离能最高的为_____,元素电负性由大到小的顺序为________。
③水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中O的杂化轨道类型为_____,其H-O-H键角_______(填“>”或“<”)H2O中H-O-H的键角。H5O2+内部存在氢键,H5O2+的结构式可表示为__________。
④Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:![]() ,其中每个Cu原子能与其他原子形成_________个配位键。
,其中每个Cu原子能与其他原子形成_________个配位键。
(2)CuCl结构属于立方晶系,其晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。则A原子分数坐标为_________。
②晶胞中距离每个Cu+最近的Cl-的个数为_______,若晶胞的棱长为a pm,晶体的密度为ρ g·cm-3,计算阿伏加德罗常数NA=________(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图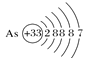 B.BF4—的结构式
B.BF4—的结构式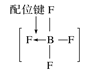
C.HF分子间的氢键 D.丙氨酸的手性异构
D.丙氨酸的手性异构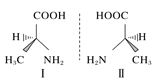
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一.种重要的化工原料,在农业、电化学和建筑等领域均有广泛应用。以含锰废料(含有MnO2 、CuO、Fe和少量CaO)为原料制备MnSO4的一种流程如下:
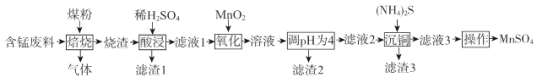 已知:
已知:
I .烧渣中含有MnO、CuO、Cu、Fe、CaO。
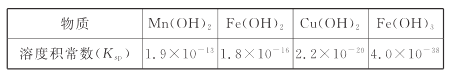
II.难溶电解质的溶度积常数如下表所示:
回答下列问题:
(1)“焙烧”过程加入煤粉的主要作用为___________________________。
(2)“酸浸”时所加稀H2SO4不宜过量太多的原因为______________________________.滤渣1的主要成分为_____________________(填化学式)。
(3)“氧化”过程中主要反应的离子方程式为__________________。
(4)“调pH为4”的目的为______________________;若“溶液”中c(Cu2+ )=0.022 mol/L,“滤液2”的体积是“溶液”体积的2倍,则“调pH为4”时Cu2+是否开始沉淀____________(通过计算说明)。
(5)(NH4)2S的电子式为___________________。
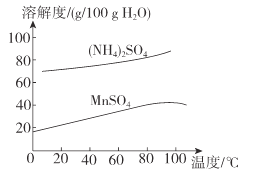
(6)已知:(NH4)2SO4与MnSO4的溶解度曲线如图所示。“操作”主要包括蒸发浓缩_______、过滤 、洗涤、干燥;其中用乙醇代替水洗涤的原因为__________,需控制温度为____( 填选项字母)得到产品最多。
A.10°C B.40 °C C.60 °C D.100°C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,有科研工作者提出可用如图所示装置进行水产养殖用水的净化处理。该装置工作时,下列说法错误的是
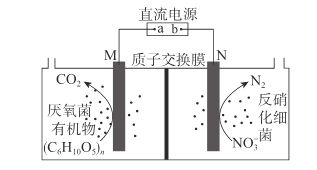
A.导线中电子由M电极流向a极
B.N极的电极反应式为2NO3-+10e-+12H+=N2↑+6H2O
C.当电路中通过24 mol电子的电量时,理论上有1 mol (C6H10O5)n参加反应
D.当生成1 mol N2时,理论上有10 mol H+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)和氨均为重要的化工原料。回答下列问题:
已知:I.N2H4(l)+O2(g)![]() N2(g)+2H2O(l) △H=-624.0 kJ/mol
N2(g)+2H2O(l) △H=-624.0 kJ/mol
II.N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
III.2NH3(g)![]() N2H4(l)+H2(g) △H=+144.8 kJ/mol
N2H4(l)+H2(g) △H=+144.8 kJ/mol
(1)H2的燃烧热△H=_____________。
(2)T1 °C时,向恒容的密闭容器中加入1 mol N2H4和1 mol O2,发生反应I。达到平衡后,只改变下列条件,能使N2的平衡体积分数增大的是_______( 填选项字母)。
A.增大压强 B.再通入一定量O2
C.分离出部分水 D.降低温度
(3)在恒压绝热的密闭容器中通入一定量的N2和H2,发生反应II和反应III。反应III对N2的平衡转化率的影响为_____(填“增大”“减小”或“无影响”),理由为___________。
(4)t2°C时,向刚性容器中充入NH3,发生反应III。NH3和H2的分压(p)与时间(t)的关系如图所示。
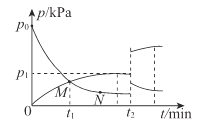
①0~t1min内,反应的平均速率v(NH3)=____kPa/min
②反应的平衡常数Kp=______kPa-1 (Kp为用分压表示的平衡常数)。
③反应物分子的有效碰撞几率:M____N(填“>”“<”或“=”)。
④t2 min时升高温度,再次达到平衡后,H2的分压增大的原因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸___。
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2___(选填“是”或“否”).混合液中离子浓度c(A-)与c(Na+)的大小关系是___。
(3)丙组实验结果分析,HA是___酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=___molL-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验 Na2O2试样是否变质为 Na2CO3:向试样中加入盐酸,产生无色无味的气体
B.检验某卤代烃是否是氯代烃: 试样 ![]() 冷却
冷却![]()
![]() 出现白色沉淀
出现白色沉淀
C.除去溴乙烷中混有的溴:混合液![]()
![]() 溶液分层
溶液分层![]() 得下层
得下层
D.鉴定盐 A 的成分是 FeBr2:
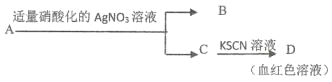
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是指导化学学习的重要工具,下图为元素周期表的一部分,请按要求填空:

(1)N在元素周期表中的位置是______________ ;N和F处于同一行,是由于它们的 __________ 相同。
(2)以上元素中,原子半径最小的是 ________ (写元素符号);最高价氧化物对应水化物中酸性最强的是 ______________ (写化学式)。
(3)Mg和Al中,金属性较强的是 __________ (写元素符号),写出一条能说明该结论的事实_________________________________。
(4) S和Cl中,非金属性较强的是 __________ (写元素符号),不能说明该结论的事实是_________。
a.氯气与铁反应生成 FeCl3,硫与铁反应生成FeS
b.把 Cl2通入 H2S溶液中能发生置换反应
c.受热时 H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com