
【题目】铜是重要的贵重金属,其化合物在催化剂研究和光电材料等方面应用广泛。回答下列问题:
(1)在铜的配合物中,H2O、NH3、CO等常用作配体。
①基态Cu2+的价电子轨道表示式为_________。
②H、C、N、O元素中,元素的第一电离能最高的为_____,元素电负性由大到小的顺序为________。
③水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中O的杂化轨道类型为_____,其H-O-H键角_______(填“>”或“<”)H2O中H-O-H的键角。H5O2+内部存在氢键,H5O2+的结构式可表示为__________。
④Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:![]() ,其中每个Cu原子能与其他原子形成_________个配位键。
,其中每个Cu原子能与其他原子形成_________个配位键。
(2)CuCl结构属于立方晶系,其晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。则A原子分数坐标为_________。
②晶胞中距离每个Cu+最近的Cl-的个数为_______,若晶胞的棱长为a pm,晶体的密度为ρ g·cm-3,计算阿伏加德罗常数NA=________(列式表示)。
【答案】![]() N O>N>C>H sp3 >
N O>N>C>H sp3 > ![]() 或
或![]() 3
3 ![]() 4
4 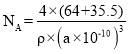
【解析】
(1)①基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
②同周期第ⅡA和第ⅤA的元素第一电离能大于相邻族元素,同周期从左到右电负性增强;
③先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;氧原子可与氢原子形成氢键;
④形成配位键时,亚铜离子提供空轨道,氯原子提供共用电子对;
(2)①根据A原子在晶胞中的位置关系分析判断;
②根据图知,该晶胞中距离每个Cu+最近的Cl-的个数为4,根据晶胞密度公式ρ=![]() 进行计算。
进行计算。
(1)①基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,基态Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9,其价电子轨道表示式为![]() ;
;
②同周期第ⅡA和第ⅤA的元素第一电离能大于相邻族元素,所以第一电离能N>O,H、C、N、O元素中,元素的第一电离能最高的为N;同周期从左到右电负性增强,所以电负性O>N>C>H;
③H3O+价层电子对模型为四面体,氧原子采取sp3杂化;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中HOH键角比H2O中HOH键角大;H5O2+内部存在氢键,H5O2+的结构式可表示为![]() 或
或![]() ;
;
④根据氯原子最外层电子数为7可知,氯原子可形成一对共用电子对,即氯原子形成的两条共价键中只有一条为配位键,而X可形成三条配位键, 如图所示: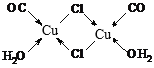 ;
;
(2)①C点的原子与上平面面心的小球相连,且与顶点组成等边三角形,故在x、y平面的投影为(![]() ,
,![]() ),同理可得在z轴的投影为
),同理可得在z轴的投影为![]() ,则A原子分数坐标为(
,则A原子分数坐标为(![]() ,
,![]() ,
,![]() );
);
②根据图知,该晶胞中距离每个Cu+最近的Cl的个数为4,氯离子的配位数是4;该晶胞中,氯原子位于晶胞的顶点和面心,氯原子的个数=8×![]() +6×
+6×![]() =4,铜原子位于晶胞内部,铜原子个数=4若晶胞的棱长为a pm,则晶胞的体积V=a3 pm3= (a×10-10)3cm3,晶体的密度为ρ g·cm-3,ρ=
=4,铜原子位于晶胞内部,铜原子个数=4若晶胞的棱长为a pm,则晶胞的体积V=a3 pm3= (a×10-10)3cm3,晶体的密度为ρ g·cm-3,ρ=![]() ,阿伏加德罗常数
,阿伏加德罗常数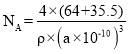 。
。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。下列说法中,不正确的是
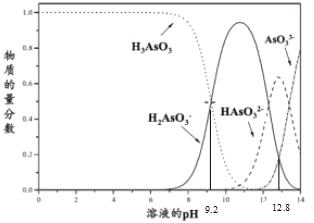
A. K3AsO3溶液中的水解方程式:AsO33-+H2O![]() HAsO32-+OH-
HAsO32-+OH-
B. pH=12.8时,c(HAsO32-) >c(H2AsO3-)=c(AsO33-)
C. pH = 12时,溶液中c(H2AsO3-) + 2c(HAsO32-) + 3c(AsO33-) + c(OH-) = c(H+)
D. pH=9.2时,在H2AsO3-和H3AsO3的混合溶液中:c(H2AsO3-):c(H3AsO3)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结钩如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列说法错误的是
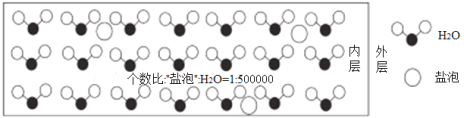
A.海冰的坚固程度不如淡水冰
B.海冰内层“盐泡”越多,密度越小
C.海冰内层NaCl的浓度约为10-4 mol·L1 (设冰的密度为0.9g·cm3)
D.海冰冰龄越长,内层的“盐泡”越少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水:C1-+2H2O![]() H2↑+Cl2↑+OH-
H2↑+Cl2↑+OH-
B.铅蓄电池充电时阳极反应式为:PbSO4–2e-+2H2O=PbO2+4H++SO42―
C.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH-
D.钢铁发生电化学腐蚀的正极反应式:Fe–2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物K是治疗急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病药物的中间体,其合成路线如下,回答下列问题:

已知信息:
①
②![]()
③ R1CHO+R2NH2 ![]() R1CH=NR2
R1CH=NR2
(1)A的名称为_______,G的结构简式为_____,F→G的反应类型为___,H中官能团的名称为___________。
(2)D→E的反应方程式为______。
(3)写出化合物D同时符合下列条件的同分异构体的结构简式______。
①苯环上有两个取代基,官能团与D相同,苯环上的一氯代物有两种
②核磁共振氢谱显示峰面积比为2:2:2:3
(4)已知:通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。写出以![]() 和
和![]() 为原料制备
为原料制备 的合成路线 __(其他试剂任选)。
的合成路线 __(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
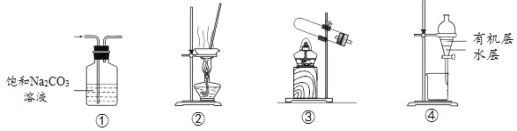
A.用①装置除去CO2中含有的少量SO2
B.用②装置蒸干饱和AlCl3溶液制备AlCl3晶体
C.用③装置加热NH4Cl固体制取NH3
D.用④装置分离乙酸乙酯与水的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用氯酸钠(NaClO3)为原料制取,(常温下ClO2为气态),下列说法错误的是
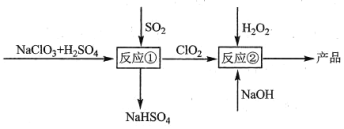
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.反应①后生成的气体要净化后进入反应②装置
C.升高温度,有利于反应②提高产率
D.反应②中有气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组从富含NaBr的工业废水中提取Br2的过程主要包括:氧化、萃取、分液、蒸馏等步骤。已知:可能用到的数据信息和装置如下。
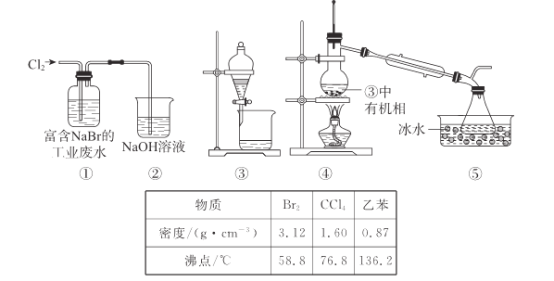
下列说法错误的是
A.实验时,①的废水中出现红色
B.②的作用是吸收尾气,防止空气污染
C.用③进行萃取时,选择CCl4比乙苯更合理
D.④中温度计水银球低于支管过多,导致Br2的产率低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com