
【题目】可逆反应达到平衡状态的主要特征是
A. 正、逆反应的速率均为零B. 正、逆反应都还在进行
C. 正、逆反应的速率相等D. 反应停止了
科目:高中化学 来源: 题型:
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋又被称为绿色宝库,下列关于海洋的说法正确的是( )
A.海洋约占地球表面积的71%B.海水中元素仅为有限的十几种
C.蒸馏是海水淡化的唯一方法D.海水因有腐蚀性而不能冷却循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是( )
A.加入明矾,使海水中的盐沉淀而淡化B.利用太阳能,将海水蒸馏淡化
C.利用电渗析法使海水淡化D.将海水通过离子交换树脂,以除去所含的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1mol甲基(-CH3)含有的质子数为9NA
B. 31gP4(![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C. 铜与浓硝酸反应生成1 moI NO2转移的电子数为NA
D. 22.4L(标准状况)氯气溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是

A. 碳[C(s)]的燃烧热△H为 -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O放出73kJ的热量
C. 反应2Cu2O(s)+O2(g)=4CuO(s)的活化能为292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= +35.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氧气的混合气体24g充分反应后,测得生成水18g,则原混合气体中氢气和氧气的质量比可能是( )
A.1:4B.1:11C.2:1D.1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
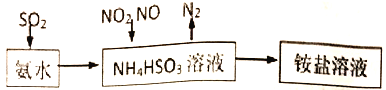
①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=__________mol/L(填确值)
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_____________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g)![]() 2CO2(g) △H3
2CO2(g) △H3
则2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g) △H4=______________________。
4HNO3(g) △H4=______________________。
②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因______________________。
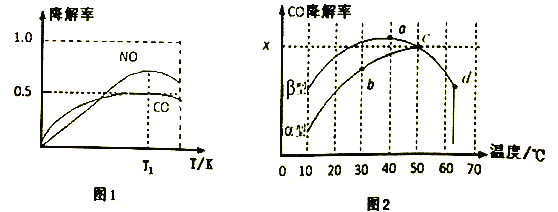
(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________________________________。(用含x的代数式表示)
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com