
【题目】氢气和氧气的混合气体24g充分反应后,测得生成水18g,则原混合气体中氢气和氧气的质量比可能是( )
A.1:4B.1:11C.2:1D.1:8
【答案】B
【解析】
根据充分反应后生成18g水,利用化学反应方程式可知,2g氢气和16g氧气恰好完全反应生成18g水,则24g混合气体有剩余的气体存在,则有两种可能:①剩余气体为氢气;②剩余气体为氧气来分析解答。
根据反应方程式:2H2+O2![]() 2H2O可知:反应产生18g水,会消耗2gH2,16gO2,二者的质量和为m(H2)+m(O2)=2g+16g=18g<24g,说明反应物有一种过量。剩余气体质量为24g-18g=6g
2H2O可知:反应产生18g水,会消耗2gH2,16gO2,二者的质量和为m(H2)+m(O2)=2g+16g=18g<24g,说明反应物有一种过量。剩余气体质量为24g-18g=6g
①若剩余气体为H2,则H2的质量为2g+6g =8g,则混合气体中有8g氢气和16g氧气,氢气和氧气的质量比8:16=1:2;
②若剩余气体为O2,则O2的质量为16g+6=22g,则混合气体中有2g氢气和22g氧气,氢气和氧气的质量比为2:22=1:11;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】任何物质的水溶液都存在水的电离平衡,其电离方程式可表示为:![]() 。下表是不同温度下水的离子积数据:
。下表是不同温度下水的离子积数据:
温度(℃) | 25 |
|
|
水的离子积常数 |
| a |
|
完成下列填空:
(1)25℃时,向100mL纯水中加入0.01mol的![]() 固体,________(选填“促进”或“抑制”)了水的电离平衡,所得溶液呈________性(选填“酸”、“碱”或“中”),原因是(用离子反应方程式表示)________________________。
固体,________(选填“促进”或“抑制”)了水的电离平衡,所得溶液呈________性(选填“酸”、“碱”或“中”),原因是(用离子反应方程式表示)________________________。
(2)若![]() ,则a________
,则a________![]() (选填“
(选填“![]() ”、“
”、“![]() ”或“=”),理由是____________。
”或“=”),理由是____________。
(3)![]() ℃时,测得纯水的
℃时,测得纯水的![]() ,则
,则![]() ________mol/L;该温度下某盐酸溶液的
________mol/L;该温度下某盐酸溶液的![]() ,该溶液的
,该溶液的![]() ________mol/L。
________mol/L。
(4)![]() ℃时,0.01mol/L的NaOH溶液的
℃时,0.01mol/L的NaOH溶液的![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。回答下列问题:
(1)多硫化钠(Na2S5)可由H2S与Na2S在一定条件下反应制得,该反应的还原产物为___________,Na2S5中含有的化学键类型是______________________。
(2)多硫化物MS4溶液在碱性条件下可高效处理高浓度含CN-电镀废水,CN-被氧化成毒性较小的SCN-,S2-转化为S2-。
①M的离子与S2-具有相同的核外电子排布,则M在周期表中的位置是___________。
②CN-的电子式为______________________。
③处理废水的离子方程式为______________________。
(3)过硫化铵[(NH4)2S2]可用作硫化试剂,为探究其性质,某研究小组进行如下实验:取含1.00g(NH4)2S2的溶液加入足量稀硫酸酸化,得到0.32g淡黄色不溶物A和氢化物B。
①A是___________,生成的B在标准状况的体积为___________mL。
②利用(NN4)2S2溶液中的活性硫能将硫锡矿中的难溶物硫化亚锡(II)(SnS)氧化成硫代锡(IV)酸铵[(NH4)2SnS3]而溶解,写出反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论正确的是( )
A. X中有两种溶质
B. Y通入纯水中得到酸性溶液
C. 原混合粉末的总质量小于7.8 g
D. 当V=1 680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物R的结构简式如图所示.下列有关R的性质叙述正确的是
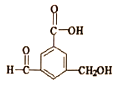
A. R的所有原子一定在同一平面上
B. 在Ni催化和加热条件下,1mol R能与5molH2发生加成反应
C. R既能与羧酸、醇反应,还能发生加成、氧化反应
D. 1mol R与足量氢氧化钠溶液反应,消耗氢氧化钠的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,反应C(s)+CO2(g) ![]() 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
B. 向醋酸中加水稀释,溶液中所有离子浓度均减小
C. 溶度积常数Ksp与温度有关,温度越高,溶度积越大
D. 吸热反应在常温下不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌铜合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:
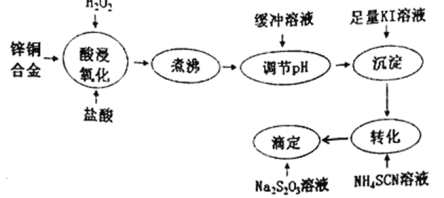
回答下列问题:
(1)H2O2的电子式为___________;“酸浸氧化”后铜元素的主要存在形式是___________(填离子符号)。
(2)“煮沸”的目的是____________________________________________。
(3)用缓冲溶液“调pH”是为了避免溶液的酸性太强,否则“滴定”时发生反应的离子方程式:_______________________________________________________;
①若100mLNa2S2O3溶液发生上述反应时,20s后生成的SO2比S多6.4g,则v(Na2S2O3)=___________mol/(L·s)(忽略溶液体积变化的影响)。
②该缓冲溶液是浓度均为0.10mol/L的CH3COOH和 CH3 COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________________________________。(已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5)
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为______________________。
(5)“转化”步骤中,CuI转化为 CuSCN, CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN-):c(I-)≥___________。(已知:Ksp(CuI)=1.0×10-12;Ksp( CuSCN)=4.4×10-15)
(6)下列情况可能造成测得的铜含量偏高的是___________(填标号)。
A.铜锌合金中含少量铁
B.“沉淀”时,I2与I-结合生成I3-:I2+ I-= I3-
C.“转化后的溶液在空气中放置太久,没有及时滴定
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定2L密闭容器中,充入X、Y各2 mol,发生可逆反应 X(g)+2Y(g) ![]() 2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,
2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,

则Y的平衡浓度(mol / L)表示式正确的是(式中S指对应区域的面积)
A、2 – S aob B、1 – Saob
C、2 – S abdo D、1 – S bod
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com