
【题目】多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。回答下列问题:
(1)多硫化钠(Na2S5)可由H2S与Na2S在一定条件下反应制得,该反应的还原产物为___________,Na2S5中含有的化学键类型是______________________。
(2)多硫化物MS4溶液在碱性条件下可高效处理高浓度含CN-电镀废水,CN-被氧化成毒性较小的SCN-,S2-转化为S2-。
①M的离子与S2-具有相同的核外电子排布,则M在周期表中的位置是___________。
②CN-的电子式为______________________。
③处理废水的离子方程式为______________________。
(3)过硫化铵[(NH4)2S2]可用作硫化试剂,为探究其性质,某研究小组进行如下实验:取含1.00g(NH4)2S2的溶液加入足量稀硫酸酸化,得到0.32g淡黄色不溶物A和氢化物B。
①A是___________,生成的B在标准状况的体积为___________mL。
②利用(NN4)2S2溶液中的活性硫能将硫锡矿中的难溶物硫化亚锡(II)(SnS)氧化成硫代锡(IV)酸铵[(NH4)2SnS3]而溶解,写出反应的离子方程式___________。
【答案】H2 离子键、共价键 第4周期 ⅡA族 ![]() S42-+3CN-=S2-+3SCN- S(或硫) 224 S22-+SnS=SnS32-
S42-+3CN-=S2-+3SCN- S(或硫) 224 S22-+SnS=SnS32-
【解析】
(1) H2S与Na2S在一定条件下反应生成多硫化钠(Na2S5)和氢气,根据氧化还原反应原理可知,反应为4H2S+Na2S=Na2S5+4H2↑,其中氢元素由+1价变为0价被还原生成氢气,故该反应的还原产物为H2,活泼金属元素与活泼非金属元素易形成离子键,非金属元素之间易形成共价键,可见Na2S5中钠离子与S52-之间存在离子键,S原子之间存在共价键,故含有的化学键类型是离子键和共价键;
(2)①M的离子与S2-具有相同的核外电子排布,均为18电子结构,则M为钙离子,在周期表中的位置是第四周期ⅡA族;
②CN-离子中碳原子和氮原子均达8电子结构,故电子式为![]() ;
;
③处理废水是S42-与CN-反应生成S2-和SCN-,反应的离子方程式为S42-+3CN-=S2-+3SCN-;
(3)过硫化铵[(NH4)2S2]与稀硫酸反应生成淡黄色不溶物硫和氢化物硫化氢和硫酸铵,发生反应的化学方程式为(NH4)2S2+H2SO4=(NH4)2SO4+S↓+H2S↑,
①A是S或硫,生成的B的物质的量为n(H2S)=n(S)= 0.32g÷32g/mol=0.01mol,在标准状况的体积为0.01mol ×22.4L/mol=0.224L=224mL;
②利用(NN4)2S2溶液中的活性硫能将硫锡矿中的难溶物硫化亚锡(II)(SnS)氧化成硫代锡(IV)酸铵[(NH4)2SnS3]而溶解,反应的离子方程式为S22-+SnS=SnS32-。


科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ ![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。


下列叙述中正确的是
A. 甲组操作时,电流表(A)指针发生偏转
B. 甲组操作时,溶液颜色变浅
C. 乙组操作时,C2作正极
D. 乙组操作时,C1上发生的电极反应为I2+2e-=2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1mol甲基(-CH3)含有的质子数为9NA
B. 31gP4(![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C. 铜与浓硝酸反应生成1 moI NO2转移的电子数为NA
D. 22.4L(标准状况)氯气溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是

A. 碳[C(s)]的燃烧热△H为 -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O放出73kJ的热量
C. 反应2Cu2O(s)+O2(g)=4CuO(s)的活化能为292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= +35.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 锌与CH3COOH溶液反应:Zn+2H+===Zn2++H2↑
B. 氢氧化铝与稀硝酸反应:H++OH-===H2O
C. CuCl2溶液与铁粉反应:3Cu2++2Fe===3Cu+2Fe3+
D. MgCl2溶液与氨水反应:Mg2++2NH3·H2O===Mg(OH)2↓+2NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氧气的混合气体24g充分反应后,测得生成水18g,则原混合气体中氢气和氧气的质量比可能是( )
A.1:4B.1:11C.2:1D.1:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和 Li4 Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是
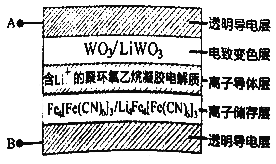
A. 当A外接电源负极时,此时Li+得到电子被还原
B. 当A外接电源正极时,膜的透射率降低,可以有效阻挡阳光
C. 当B外接电源正极时,离子导体层中Li+向下迁移
D. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4e-=Li4Fea[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com