
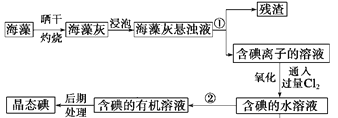
ЁОЬтФПЁПFeЪЧШЫЬхВЛПЩШБЩйЕФЮЂСПдЊЫиЃЌЩуШыКЌЬњЛЏКЯЮяПЩВЙГфЬњЃЌСђЫсбЧЬњОЇЬх(FeSO4ЁЄ7H2O)дквНвЉЩЯзїВЙбЊМСЃЌФГПЮЭтаЁзщВтЖЈИУВЙбЊМСжаЬњдЊЫиЕФКЌСПЃЎЪЕбщВНжшШчЯТЃКЃК
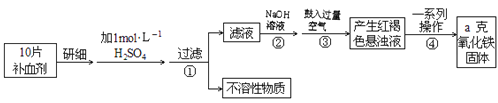
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉВНжшЂкжаМгШызуСПNaOHЗЂЩњЕФжївЊЗДгІЕФРызгЗНГЬЪНЮЊ______________ЁЃВНжшЂлжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________________ЁЃ
ЃЈ2ЃЉВНжшЂмжавЛЯЕСаДІРэЕФВйзїВНжшЃК___________ЁЂЯДЕгЁЂ___________ЁЂРфШДЁЂГЦСПЃЎ
ЃЈ3ЃЉЪЕбщжаашгУ98%ХЈСђЫс(УмЖШ1.84g/mL)ХфжЦ1mol/LЕФЯЁСђЫс480mLЃЌХфжЦЪБгУЕНЕФВЃСЇвЧЦїГ§СПЭВЁЂЩеБЁЂНКЭЗЕЮЙмЁЂВЃСЇАєЭтЛЙга___________ЃЌашгУСПЭВСПШЁХЈСђЫс________mLЁЃ
ЃЈ4ЃЉШєЪЕбщЮоЫ№КФЃЌдђУПЦЌВЙбЊМСКЌЬњдЊЫиЕФжЪСП___________g(гУКЌaЕФДњЪ§ЪНБэЪО)
ЁОД№АИЁПFe2++2OH-=Fe(OH)2Ё§ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Й§ТЫ зЦЩе 500mLШнСПЦП 27.2mL 0.07a
ЁОНтЮіЁП
ЃЈ1ЃЉВНжшЂкжаМгШызуСПNaOHЃЌСђЫсбЧЬњгыЧтбѕЛЏФЦЗДгІЩњГЩЧтбѕЛЏбЧЬњЃЌЧтбѕЛЏбЧЬњБЛПеЦјжаЕФбѕЦјбѕЛЏЃЌЗЂЩњЕФжївЊЗДгІЕФРызгЗНГЬЪНЮЊFe2++2OH-=Fe(OH)2Ё§ЃЛ4Fe(OH)2+O2+2H2O=4Fe(OH)3ЃЌЙЪД№АИЮЊFe2++2OH-=Fe(OH)2Ё§ЃЛ4Fe(OH)2+O2+2H2O=4Fe(OH)3ЃЛ
ЃЈ2ЃЉВНжшЂмжавЛЯЕСаДІРэЪЧгЩЧтбѕЛЏЬњаќзЧвКзюжезЊЛЏЮЊбѕЛЏЬњЃЌашвЊЙ§ТЫЁЂЯДЕгЕФЧтбѕЛЏЬњЃЌШЛКѓзЦЩеЩњГЩбѕЛЏЬњЃЌРфШДКѓГЦСПбѕЛЏЬњЕФжЪСПЃЌЙЪД№АИЮЊЙ§ТЫЃЛзЦЩеЃЛ
ЃЈ3ЃЉХфжЦ480mL 1mol/LЕФЯЁСђЫсЃЌХфжЦЪБашвЊЕФвЧЦїгаВЃАєЁЂЩеБЁЂНКЭЗЕЮЙмЁЂ500mLШнСПЦПЁЂСПЭВЃЛХЈСђЫсЕФЮяжЪЕФСПХЈЖШ=![]() =
=![]() =18.4mol/LЃЌХфжЦ480mL 1mol/LЕФЯЁСђЫсЃЌашгУСПЭВСПШЁХЈСђЫсЕФЬхЛ§=
=18.4mol/LЃЌХфжЦ480mL 1mol/LЕФЯЁСђЫсЃЌашгУСПЭВСПШЁХЈСђЫсЕФЬхЛ§=![]() =0.0272L=27.2mLЃЌЙЪД№АИЮЊ500mLШнСПЦПЃЛ27.2mLЃЛ
=0.0272L=27.2mLЃЌЙЪД№АИЮЊ500mLШнСПЦПЃЛ27.2mLЃЛ
ЃЈ4ЃЉagбѕЛЏЬњжаЬњдЊЫиЕФжЪСПМДЮЊ10ЦЌВЙбЊМСжаЬњЕФжЪСПЃЌЫљвдУПЦЌВЙбЊМСКЌЬњдЊЫиЕФжЪСП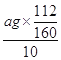 =0.07agЃЌЙЪД№АИЮЊ0.07aЁЃ
=0.07agЃЌЙЪД№АИЮЊ0.07aЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛьКЯЮяНЌвККЌAl(OH)3ЁЂMnO2КЭЩйСПNa2CrO4ЁЃПМТЧЕННКЬхЕФЮќИНзїгУЪЙNa2CrO4ВЛвзЭъШЋБЛЫЎНўГіЃЌФГбаОПаЁзщРћгУЩшМЦЕФЕчНтЗжРызАжУЃЈМћЭМ2ЃЉЃЌЪЙНЌвКЗжРыГЩЙЬЬхЛьКЯЮяКЭКЌИѕдЊЫиШмвКЃЌВЂЛиЪеРћгУЁЃЛиД№ЂёКЭЂђжаЕФЮЪЬтЁЃ

ЂёЃЎЙЬЬхЛьКЯЮяЕФЗжРыКЭРћгУЃЈСїГЬЭМжаЕФВПЗжЗжРыВйзїКЭЗДгІЬѕМўЮДБъУїЃЉ
ЃЈ1ЃЉЗДгІЂйЫљМгЪдМСNaOHЕФЕчзгЪНЮЊ_________ЃЌBЁњCЕФЗДгІЬѕМўЮЊ__________ЃЌCЁњAlЕФжЦБИЗНЗЈГЦЮЊ______________ЁЃ
ЃЈ2ЃЉИУаЁзщЬНОПЗДгІЂкЗЂЩњЕФЬѕМўЁЃDгыХЈбЮЫсЛьКЯЃЌВЛМгШШЃЌЮоБфЛЏЃЛМгШШгаCl2ЩњГЩЃЌЕБЗДгІЭЃжЙКѓЃЌЙЬЬхгаЪЃгрЃЌДЫЪБЕЮМгСђЫсЃЌгжВњЩњCl2ЁЃгЩДЫХаЖЯгАЯьИУЗДгІгааЇНјааЕФвђЫигаЃЈЬюађКХЃЉ___________ЁЃ
aЃЎЮТЖШ bЃЎCl-ЕФХЈЖШ cЃЎШмвКЕФЫсЖШ
ЃЈ3ЃЉ0.1 mol Cl2гыНЙЬПЁЂTiO2ЭъШЋЗДгІЃЌЩњГЩвЛжжЛЙдадЦјЬхКЭвЛжжвзЫЎНтГЩTiO2ЁЄxH2OЕФвКЬЌЛЏКЯЮяЃЌЗХШШ4.28 kJЃЌИУЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ__________ЁЃ
ЂђЃЎКЌИѕдЊЫиШмвКЕФЗжРыКЭРћгУ
ЃЈ4ЃЉгУЖшадЕчМЋЕчНтЪБЃЌCrO42-ФмДгНЌвКжаЗжРыГіРДЕФдвђЪЧ__________ЃЌЗжРыКѓКЌИѕдЊЫиЕФСЃзгЪЧ_________ЃЛвѕМЋЪвЩњГЩЕФЮяжЪЮЊ___________ЃЈаДЛЏбЇЪНЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂёЃЎЃЈ1ЃЉжИГіШчЯТЭМЪЕбщзАжУжаЕФДэЮѓжЎДІ(МгШШзАжУжаЩеБЕзВПвбЕцгаЪЏУоЭј)
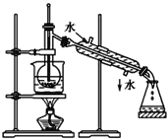
Ђй_____________ЃЛЂк_________ЁЃ
ЃЈ2ЃЉЭМЪЧФГбЇЩњЕФЙ§ТЫВйзїЪОвтЭМЃЌЦфВйзїВЛЙцЗЖЕФЪЧ______
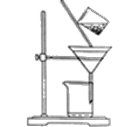
a ТЉЖЗЯТПкМтЖЫЮДНєППЩеББк b ВЃСЇАєгав§СїзїгУ
c НЋТЫжНЪЊШѓЃЌЪЙЦфНєЬљТЉЖЗБк d ТЫжНБпдЕЕЭгкТЉЖЗПкБпдЕ
e гУВЃСЇАєдкТЉЖЗжаЧсЧсНСЖЏвдМгПьЙ§ТЫЫйЖШ
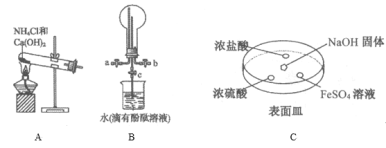
Ђђ.КЃдхжаЬсШЁЕтЕФСїГЬШчЭМЃЌвбжЊбѕЛЏЙ§ГЬЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКCl2+2KI=2KCl+I2ЁЃЧыЛиД№ЯТСаЮЪЬтЃК

ЃЈ1ЃЉжИГіЬсШЁЕтЕФЙ§ГЬжагаЙиЪЕбщВйзїЂйКЭЂкЕФУћГЦЃК__________ЃЛ________ЁЃ
ЃЈ2ЃЉдк3 mLКЌЕтЕФЫЎШмвКжаМгШы1mLЫФТШЛЏЬМЃЌеёЕДОВжУКѓЙлВьЕНЪдЙмРяЕФЗжВуЯжЯѓЪЧЩЯЭМжаЕФ_____(зЂЃКЪдЙмжаЩюЩЋЧјЮЊгаЩЋШмвК)ЃЌЩЯВуЮоЩЋШмвКЕФШмжЪЪЧ_____ЯТВубеЩЋЪЧ_____ЁЃ
ЃЈ3ЃЉДгКЌЕтЕФгаЛњШмвКжаЬсШЁЕтКЭЛиЪегаЛњШмМСЃЌЛЙашОЙ§ЕФВйзїЪЧ_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЏбЇЗДгІЕФРызгЗНГЬЪНе§ШЗЕФЪЧ( )
AЃЎ0.01mol/L NH4Al(SO4)2ШмвКгы0.02mol/L Ba(OH)2ШмвКЕШЬхЛ§ЛьКЯNH4++Al3++2SO42Љ+2Ba2++4OHЉ=2BaSO4Ё§+Al(OH)3Ё§+NH3H2O
BЃЎNa2O2МгШыH218OжаЃК2Na2O2+2H218O=4Na++4OHЉ+18O2Ёќ
CЃЎNH4HCO3ШмвКгыЙ§СПNaOHШмвКЙВШШЃКNH4++OHЉ![]() NH3Ёќ+H2O
NH3Ёќ+H2O
DЃЎХЈЯѕЫсжаМгШыЙ§СПЬњЗлВЂМгШШЃКFe+3NO3Љ+6H+![]() Fe3++3NO2Ёќ+3H2O
Fe3++3NO2Ёќ+3H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПяЎЁЊЭПеЦјШМСЯЕчГиЪЧЕЭГЩБОИпаЇЕчГиЁЃИУЕчГиЭЈЙ§вЛжжИДдгЕФЭЁАИЏЪДЁБЯжЯѓВњЩњЕчФмЃЌЦфжаЗХЕчЙ§ГЬЮЊ2LiЃЋCu2OЃЋH2O===2CuЃЋ2Li+ЃЋ2OHЃЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
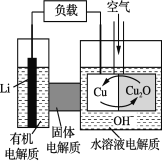
A. ЗХЕчЪБЃЌLi+ЭИЙ§ЙЬЬхЕчНтжЪЯђCuМЋвЦЖЏ
B. ЭЈПеЦјЪБЃЌЭБЛИЏЪДЃЌВњЩњCu2O
C. ЗХЕчЪБЃЌе§МЋЕФЕчМЋЗДгІЪНЮЊ:Cu2OЃЋ2H+ +2 e- ===2CuЃЋH2O
D. ећИіЗДгІЙ§ГЬжаЃЌбѕЛЏМСЮЊO2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋЕШЮяжЪЕФСПЕФAКЭBЃЌЛьКЯгк2LЕФУмБеШнЦїжаЃЌЗЂЩњШчЯТЗДгІЃК3A(g)+B(g)![]() xC(g)+2D(g)ЃЌ5minКѓВтЕУc(D)=0.5mol/LЃЌc(A):c(B)=1:2ЃЌCЕФЗДгІЫйТЪЪЧ 0.15 mol/(Lmin)ЁЃ
xC(g)+2D(g)ЃЌ5minКѓВтЕУc(D)=0.5mol/LЃЌc(A):c(B)=1:2ЃЌCЕФЗДгІЫйТЪЪЧ 0.15 mol/(Lmin)ЁЃ
ЃЈ1ЃЉBЕФЗДгІЫйТЪv(B)=_____X=___
ЃЈ2ЃЉAдк5minФЉЕФХЈЖШЪЧ___
ЃЈ3ЃЉДЫЪБШнЦїФкЕФбЙЧПгыПЊЪМЪБжЎБШЮЊЃК____ЁЃ
ЃЈ4ЃЉЖўТШЛЏСђ(S2Cl2)ЪЧвЛжжчњчъЩЋвКЬхЃЌЪЧКЯГЩСђЛЏШОСЯЕФживЊдСЯЁЃаДГіЫќЕФЕчзгЪН______ЃЛ
ЃЈ5ЃЉЮјЕФдзгађЪ§ЮЊ34ЃЌЮјЕФЕЅжЪМАЦфЛЏКЯЮягУЭОЗЧГЃЙуЗКЁЃ
a.ЮјдкдЊЫижмЦкБэжаЕФЮЛжУЪЧ___ЁЃSe2Cl2ГЃгУзїЗжЮіЪдМСЃЌЦфНсЙЙЪНЮЊ___ЁЃ
b.ЮјЛЏюїЪЧвЛжжПЩгІгУгкЮДРДГЌЫуЩшБИЕФаТаЭАыЕМЬхВФСЯЁЃвбжЊюї(In)гыТСЭЌзхЧвБШТСЖрСНИіЕчзгВуЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ___ЃЈЬюзжФИЃЉЁЃ
AЃЎдзгАыОЖЃКIn>Se BЃЎInЕФН№ЪєадБШSeЧП
CЃЎInЕФН№ЪєадБШAlШѕ DЃЎЮјЛЏюїЕФЛЏбЇЪНЮЊInSe2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАБЦјдкЙЄХЉвЕЩњВњжагаживЊгІгУЁЃ
ЃЈ1ЃЉАБЕФДпЛЏбѕЛЏЪЧЙЄвЕЩњВњЯѕЫсЕФЛљДЁЃЌаДГіИУЛЏбЇЗНГЬЪН_________ЁЃ
ЃЈ2ЃЉФГЛЏбЇЪЕбщаЁзщЭЌбЇРћгУвдЯТзАжУжЦБИАБЃЌВЂЬНОПАБЕФаджЪЃЈВПЗжвЧЦївбТдШЅЃЉЁЃ
ЧыЛиД№ЃК
ЂйгУзАжУBЪеМЏАБЪБЃЌАБЕФНјЦјПкЪЧ__ЃЈбЁЬюЁАaЁБЛђЁАbЁБЃЉЁЃДђПЊзАжУBжаЕФЛюШћcЃЌШєЙлВьЕНЩеЦПФкВњЩњСЫКьЩЋХчШЊЃЌдђЫЕУїАБОпгаЕФаджЪЪЧ______ЃЌ______ЁЃ
ЂкЯђCжаNaOHЙЬЬхЩЯЕЮМИЕЮХЈАБЫЎЃЌбИЫйИЧЩЯИЧЃЌЙлВьЯжЯѓЁЃХЈбЮЫсвКЕЮИННќЛсГіЯж _____ЃЌЃЈЬюЯжЯѓЃЉЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЁЃFeSO4вКЕЮжаЯШГіЯжЛвТЬЩЋГСЕэЃЌЙ§вЛЖЮЪБМфКѓБфГЩКьКжЩЋЃЌЗЂЩњЕФЗДгІАќРЈFe2++2NH3ЁЄH2O===FeЃЈOHЃЉ2Ё§+2NH4+КЭ_________ЁЃ
ЂлЮЊЗРжЙЛЗОГЮлШОЃЌвдЯТзАжУЃЈЪЂЗХЕФвКЬхОљЮЊЫЎЃЉПЩгУгкЮќЪеЖргрАБЕФ__ЃЈЬюађКХЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕтЪЧШЫЬхжаВЛПЩШБЩйЕФдЊЫиЃЌЮЊСЫдЄЗРЕтШБЗІЃЌЭЈГЃдкОЋбЮжаЬэМгвЛЖЈЕФKIO3ЁЃФГбаОПаЁзщЮЊСЫМьВтФГМгЕтбЮжаЪЧЗёКЌгаЕтЃЌВщдФСЫгаЙизЪСЯЃЌЗЂЯжЦфМьВтдРэЪЧЃКKIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
ЃЈ1ЃЉгУЫЋЯпЧХБэЪОИУЗДгІжаЕчзгзЊвЦЕФЗНЯђКЭЪ§ФП___________________________________ЃЌИУЗДгІжаЛЙдВњЮягыбѕЛЏВњЮяЕФжЪСПжЎБШЪЧ__________ЃЌ0.2mol KIO3ВЮМгЗДгІЪБЃЌзЊвЦЕФЕчзгЮЊ________molЁЃ
ЃЈ2ЃЉЩЯУцЪЕбщжагУЕНвЛЖЈЮяжЪЕФСПХЈЖШЕФЯЁСђЫсЃЌШєХфжЦ1.0 mol/LЕФЯЁСђЫс500mLЃЌХфжЦжаашвЊгУЕНЕФжївЊВЃСЇвЧЦїга___________ЃЈЬюбЁЯюЃЉЃЌашгУ18.0mol/L ХЈСђЫс_________mLЁЃ
a.100mLСПЭВ b.ВЃСЇАє c.100mLШнСПЦП d.50mLСПЭВ e.НКЭЗЕЮЙм
f.ЩеБ g.500mLШнСПЦП
ЃЈ3ЃЉЯТУцВйзїдьГЩЫљХфЯЁСђЫсШмвКХЈЖШЦЋИпЕФга____________ЃЈЬюбЁЯюЃЉЁЃ
a.ШмНтКѓШмвКУЛгаРфШДЕНЪвЮТОЭзЊвЦЃЛb.зЊвЦЪБУЛгаЯДЕгЩеБЁЂВЃСЇАєЃЛc.зЊвЦЙ§ГЬжагаЩйСПвКЬхСїГіЃЛd.ЯђШнСПЦПМгЫЎЖЈШнЪБблОІИЉЪгвКУцЃЛe.вЁдШКѓЗЂЯжвКУцЕЭгкПЬЖШЯпЃЌгжМгеєСѓЫЎжСПЬЖШЯп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІA(g) ![]() B(g) +C(g)дкШнЛ§ЮЊ1.0LЕФУмБеШнЦїжаНјааЃЌAЕФГѕЪМХЈЖШЮЊ0.050mol/LЁЃЮТЖШT1КЭT2ЯТAЕФХЈЖШгыЪБМфЙиЯЕШчЭМЫљЪОЁЃЛиД№ЯТСаЮЪЬтЃК
B(g) +C(g)дкШнЛ§ЮЊ1.0LЕФУмБеШнЦїжаНјааЃЌAЕФГѕЪМХЈЖШЮЊ0.050mol/LЁЃЮТЖШT1КЭT2ЯТAЕФХЈЖШгыЪБМфЙиЯЕШчЭМЫљЪОЁЃЛиД№ЯТСаЮЪЬтЃК
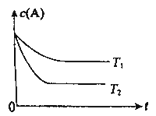
ЃЈ1ЃЉЩЯЪіЗДгІЕФЮТЖШT1____ T2ЃЌЦНКтГЃЪ§K(T1)____K(T2)ЁЃЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉ
ЃЈ2ЃЉШєЮТЖШT2ЪБЃЌ5minКѓЗДгІДяЕНЦНКтЃЌAЕФзЊЛЏТЪЮЊ70%ЃЌдђЃК
ЂйЦНКтЪБЬхЯЕзмЕФЮяжЪЕФСПЮЊ________ЁЃ
ЂкЗДгІЕФЦНКтГЃЪ§K=_______ЁЃ
ЂлЗДгІдк0~5minЧјМфЕФЦНОљЗДгІЫйТЪv(A)=________ЁЃ
ЃЈ3ЃЉвбжЊ1g FeS2ЭъШЋШМЩеЗХГі7.1kJШШСПЃЌFeS2ШМЩеЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ______ЁЃ
ЃЈ4ЃЉЮяжЪ(t-BuNO)2дке§И§ЭщШмМСжаЗЂЩњШчЯТЗДгІЃК(t-BuNO)2 ![]() 2(t-BuNO) ІЄH = 50.5 kJЁЄmol-1ЁЃИУЗДгІЕФІЄS_____0(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБ)ЁЃдк______ЬюЁАНЯИпЁБЛђЁАНЯЕЭЁБ)ЮТЖШЯТгаРћгкИУЗДгІздЗЂНјааЁЃ
2(t-BuNO) ІЄH = 50.5 kJЁЄmol-1ЁЃИУЗДгІЕФІЄS_____0(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБ)ЁЃдк______ЬюЁАНЯИпЁБЛђЁАНЯЕЭЁБ)ЮТЖШЯТгаРћгкИУЗДгІздЗЂНјааЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com