
【题目】已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ的热量。表示辛烷燃烧热的热化学方程式正确的是( )
A.2C8H18(l) +25O2(g)===16CO2(g)+18H2O(g) ΔH=-11035.2 kJ·mol-1
B.C8H18(l) +![]() O2(g) ===8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
O2(g) ===8CO2(g)+9H2O(l) ΔH=-5517.6 kJ·mol-1
C.C8H18(l) +![]() O2(g) ===8CO2(g)+9H2O(l) ΔH=—11035.2kJ·mol-1
O2(g) ===8CO2(g)+9H2O(l) ΔH=—11035.2kJ·mol-1
D.2C8H18(l) +25O2(g) ===16CO2(g)+18H2O(l) ΔH=-5517.6 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】氯化硫(S2C12)的结构式为Cl—S—S—Cl,常温下为浅黄色油状液体,遇水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓。下列有关此反应的说法正确的是
A.S2C12做氧化剂,H2O做还原剂
B.每生成l mol SO2转移4 mol电子
C.氧化产物与还原产物的物质的量之比为l:3
D.每生成48g硫会断裂2mol氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是

A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。有关说法正确的是( )
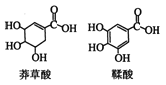
A.等浓度的两种酸其酸性相同
B.两种酸都能与溴水发生加成反应
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.鞣酸能与Fe3+发生显色反应,而莽草酸不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
NaNO3 | KNO3 | NaCl | KCl | |
10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
100℃ | 175 | 246 | 39.1 | 56.6 |
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
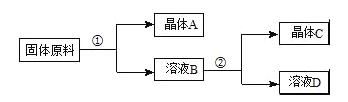
以下说法错误的是( )
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1950g发烟硫酸(用a SO3H2O 表示),SO3和H2SO4的质量分数分别为0.2和0.8,加b g水稀释成某浓度的硫酸(用H2SO4![]() H2O 表示),则以下正确的是(允许最后一位数字不同)( )
H2O 表示),则以下正确的是(允许最后一位数字不同)( )
A.a=1.38B.a=1.31C.b=174D.b=129
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的电池中,电解质溶液为酸性,则负极反应式为______________,正极反应式为__________________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH= -726.5kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
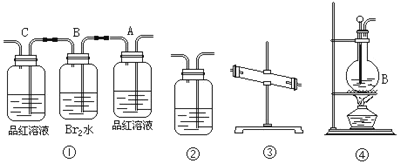
(1)用编号为①→④的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2和水蒸气。用装置的连接顺序(按产物气流从左到右的流向): → → → 。___
(2)实验的装置(1)中A瓶的现象是___;结论为___;B瓶中的现象是___;B瓶溶液作用为___。若C瓶中品红溶液不褪色,可得到结论为___。
(3)装置③中加的固体药品是___,以验证混合气体中有___。装置②中盛的溶液是___,以验证混合气体中有___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com