
【题目】下列有关化学反应速率和限度的说法不正确的是( )
A. 实验室用H2O2分解制O2,加MnO2做催化剂后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用锌和盐酸反应制取氢气,用锌粉比锌粒反应要快
科目:高中化学 来源: 题型:
【题目】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。回答下列问题:
(1)乙烷可通过热裂解和氧化裂解制取乙烯。已知下列键能数据:
化学键 | C—C | C=C | C—H | H—H |
键能/ kJ·mol -1 | 347. 7 | 615 | 413. 4 | 436. 0 |
①乙烷直接裂解制乙烯的热化学方程式为_____________________________。
②氧化裂解制乙烯的热化学方程式为C2H6(g) + ![]() O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
(2)利用生物乙醇在某种分子筛催化下可脱水制取乙烯,相应反应如下:
I. C2H5OH(g) ![]() C2H4(g) + H2O(g)
C2H4(g) + H2O(g)
Ⅱ. 2C2H5OH(g) ![]() (C2H5)2O(g) + H2O(g)
(C2H5)2O(g) + H2O(g)
平衡常数[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]及产品选择性如下图所示:
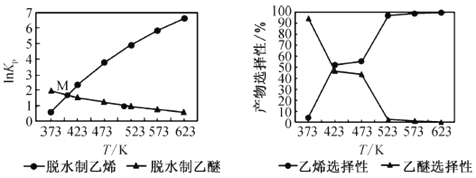
①反应 C2H5OH(g) ![]() C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
②关于上图中交点M,下列说法正确的是________(填字母)。
a. 一段时间内,反应I、Ⅱ的速率相等
b. 某温度下,反应I、Ⅱ的平衡常数相等
c. 一段时间内,反应I、Ⅱ中乙醇的转化率相等
(3)利用煤制合成气,再由合成气间接制乙烯包含的反应有:
I. CO(g) +2H2(g) ![]() CH3OH(g) △H=a kJ·mol-1
CH3OH(g) △H=a kJ·mol-1
Ⅱ. 2CH3QH(g) ![]() C2H4(g) + 2H2O(g) △H =b kJ·mol-1
C2H4(g) + 2H2O(g) △H =b kJ·mol-1
①反应 2CO(g) + 4H2(g) ![]() C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
②在容积为1 L的密闭容器中,投入2 mol CO和4 mol H2,10 min后,测得c(CO) = 1. 2 mol·L-1·min-1,则10 min内v(H2)=_____________ mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革 污泥中Cr(III)的处理工艺流程如下。
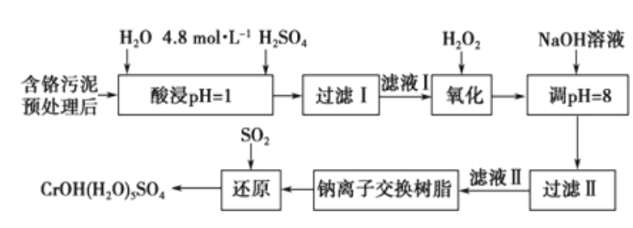
已知:①硫酸浸取后溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+;
②CrOH(H2O)5SO4难溶于水。
(1)浓H2O2溶液的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:____________。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | - | - | - |
沉淀完全时的pH | 3.7 | 11.1 | 5.2 | 5.6 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为Cr2O42-,其离子方程式为______________________。此步骤中滤液的pH调至8,通过沉淀除去的金属离子为___________;此步骤中没有继续调高将Mg2+除去,理由是______________________。
(3)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用该方法主要除去的滤液II中的Mg2+, 若测得滤液II通过钠离子交换柱后溶液中c(Na+)为amol/L,则滤液II中c(Mg2+)为___________。
(4)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
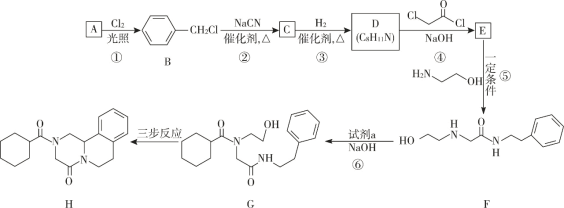
【题目】键线式是表达有机化合物结构的一种方式,如H2N—CH2—CH2—OH 用键线式可以表达为 ![]() 。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
。吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
已知:I R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii 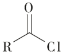 +R′—NH—R"+NaOH
+R′—NH—R"+NaOH![]()
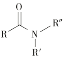 +NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
+NaCl+H2O(R、R′表示烃基,R"表示羟基或H)
(1)A 属于芳香烃,其名称是____________ 。
(2)②的反应类型是_____________ 。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为_____________ 。
(4)③中 1 mol C 理论上需要消耗 ___________mol H2 生成 D。
(5)④的化学方程式是_____________ 。
(6) 试剂 a 的结构简式是 ____________________。
(7) G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式________________、__________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中,还原性HSO3>I-,氧化性IO3->I2。在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法中错误的是
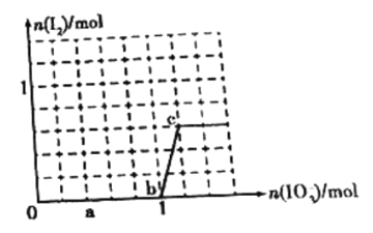
A. a点时NaHSO3剩余
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,反应后溶液中I-均为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系据此判断下列说法中正确的是
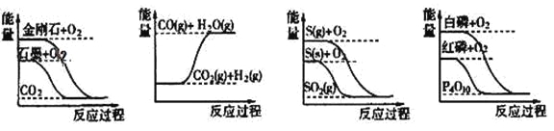
A.石墨转变为金刚石是吸热反应
B.CO(g)+H2O(g)=CO2(g)+H2(g)是吸热反应
C.相同条件下,等质量S(g)和S(s)的能量比较, S(s)较大
D.白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯在多种条件下发生水解反应:CH3COOC2H5 + H2OCH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法错误的是( )
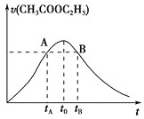
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.CH3COOC2H5的转化率tA时低于tB时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。
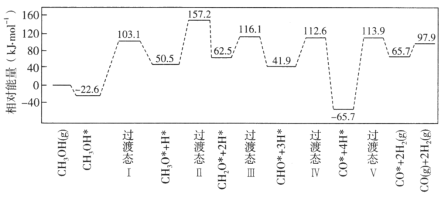
(1)![]() 的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
的△H=_____________kJ·mol-1;该历程中最大能垒(活化能)E正=____________kJ·mol-1,写出该步骤的化学方程式_________________。
(2)在一定温度下,CO和H2混合气体发生反应:![]() ,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,
,反应速率υ=υ正-υ逆=k正c(CO)·c2(H2)-k逆c(CH3OH),k正、k逆分别为正、逆反应速率常数。达到平衡后,若加入高效催化剂,![]() 将___________(填“增大”、“减小”或“不变”);若升高温度,
将___________(填“增大”、“减小”或“不变”);若升高温度,![]() 将____________(填“增大”、“减小”或“不变”)。
将____________(填“增大”、“减小”或“不变”)。
(3)353K时,在刚性容器中充入CH3OH(g),发生反应:![]() 。体系的总压强p随时间t的变化如表所示:
。体系的总压强p随时间t的变化如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
p/kPa | 101.2 | 107.4 | 112.6 | 116.4 | 118.6 | 121.2 |
①若升高反应温度至373K,则CH3OH(g)分解后体系压强p∞(373K)___________121.2kPa(填“大于”、“等于”或“小于”),原因是________________________。
②353K时,该反应的平衡常数KP=__________(kPa)2(KP为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com