

分析 验证产物中有乙烯生成且乙烯具有不饱和性流程:装置I:在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应为CH3CH2OH$→_{170℃}^{浓硫酸}$H2O+CH2=CH2↑,因浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,C+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,干扰乙烯具有不饱和性性质验证,装置II:连接球形干燥管,防止倒吸,如果发生取代反应生成物含有HBr,溶液酸性增强,若发生加成反应,水溶液PH将增大,可用PH试纸来测试反应后溶液的酸碱性变化进行确认.
(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯;
(2)浓硫酸具有强氧化性,能将乙醇氧化生成碳,自身被还原生成二氧化硫,二氧化硫含有还原性;
(3)二氧化硫属于酸性氧化物,能将二氧化硫吸收,二氧化硫能使品红溶液褪色.
解答 解:(1)在浓硫酸作催化剂、170℃加热条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$H2O+CH2=CH2↑,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$H2O+CH2=CH2↑;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,自身被还原生成二氧化硫,C+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,
故选:BC;
(3)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,所以可以用品红溶液检验二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,根据取代反应的原理,如果发生取代反应必然生成HBr使溶液酸性增强,pH变小,溴水成酸性,1,2-二溴乙烷为中性,若发生加成反应,水溶液PH将增大,故答案为:NaOH溶液;吸收SO2;品红溶液;若发生取代反应必然生成HBr使溶液酸性增强,pH变小,若发生加成反应,水溶液PH将增大.
点评 本题考查了实验室制取乙烯实验,明确实验原理是解本题关键,根据浓硫酸、乙烯的性质来分析解答,注意二氧化硫、乙烯都能使溴水褪色,但褪色原理不同,乙烯使溴水褪色是发生了加成反应,二氧化硫使溴水褪色是发生了氧化还原反应.


科目:高中化学 来源: 题型:解答题
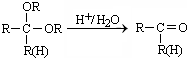
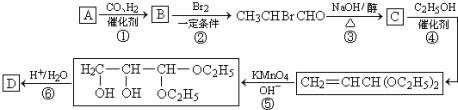
 CH2=CHCHO+NaBr+H2O.
CH2=CHCHO+NaBr+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2x | B. | m<2x | C. | m>2x | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
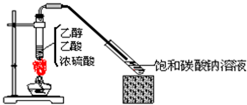 如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是
如图所示,实验室制乙酸乙酯1mL后,沿器壁加入紫色石蕊试液0.5mL,这时石蕊试液将存在于饱和碳酸钠溶液层与乙酸乙酯层之间(整个过程不振荡).对可能出现的现象,叙述正确的是| A. | 石蕊层仍为紫色,有机层无色 | |
| B. | 石蕊层有两层,上层为紫色,下层为蓝色 | |
| C. | 石蕊层为三层环,由上而下是红、紫、蓝 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 通入CO2,pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有7个中子的碳原子:${\;}_6^{13}C$ | |
| B. | HF的电子式: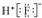 | |
| C. | CH4分子的球棍模型: | |
| D. | Cl-离子的结构示意图: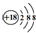 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AB3 | B. | AB | C. | A3B | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1% | |
| C. | amol•L-1H2C2O4溶液与2amol•L-1的NaOH溶液等体积混合后,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) | |
| D. | 0.1mol•L-1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com