
【题目】取50mL的Na2CO3和Na2SO4 的混合溶液,加入适量Ba(OH)2溶液50mL后,恰好完全反应,过滤得到滤液和12.54g白色沉淀(干燥后),再用足量的稀硝酸处理沉淀,最后沉淀减少到4.66g,并有气体放出。
(1)4.66g白色沉淀是_________(填化学式),写出12.54g白色沉淀加入稀硝酸后变为4.66g所发生反应的离子方程式___________________________;
(2)产生的气体在标准状况下的体积为__________ml;
(3)原混合液中Na2SO4的物质的量浓度______;
(4)计算过滤出12.54g沉淀后,所得滤液中溶质的物质的量浓度(忽略混合溶液体积的变化)______。
【答案】(1)BaSO4(1分),BaCO3+2H+=Ba2++CO2↑+H2O(2分)(2)896(1分)
(3)0.4mol/L(2分)(4)1.2mol/L(4分)
【解析】(1)过滤、干燥后得到12.54g白色沉淀为硫酸钡、碳酸钡的质量,用足量的稀硝酸处理沉淀后,沉淀最后减少到4.66g,则硫酸钡为4.66g,碳酸钡质量为:12.54g-4.66g=7.88g,稀硝酸溶解碳酸钡的离子反应方程式为BaCO3+2H+=Ba2++CO2↑+H2O;
(2)根据C元素守恒可知:n(CO2)=n(BaCO3)=![]() =0.04mol,则标准状况下生成二氧化碳的体积为:V(CO2)=0.04mol×22.4L/mol=0.896L=896mL;
=0.04mol,则标准状况下生成二氧化碳的体积为:V(CO2)=0.04mol×22.4L/mol=0.896L=896mL;
(3)根据硫酸根离子守恒可得:n(Na2SO4)=n(BaSO4)=![]() =0.02mol,原混合液中Na2SO4的物质的量浓度为:
=0.02mol,原混合液中Na2SO4的物质的量浓度为: ![]() =0.4mol/L;
=0.4mol/L;
(4)过滤出12.54g沉淀后,溶液中溶质为NaOH,根据钠离子守恒可知:n(NaOH)=2n(Na2SO4)+2n(Na2CO3)=2×0.04mol+2×0.02mol=0.12mol,混合后溶液的体积为0.1L,所得滤液中NaOH的物质的量浓度为: ![]() =1.2mol/L。
=1.2mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质变化的描述正确的是
A.石油分馏和煤的干馏都是化学变化
B.同素异体之间的转化属于化学变化,但不属于氧化还原反应
C.通过化学变化可以实现一种原子变成另一种原子
D.金属导电和电解质溶液导电都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是_______________。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.停止实验时,应先停止通入H2,后停止加热
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设:
假设1:含有Ca和CaH2;
假设2:含有CaH2和CaO;
假设3:含有__________________。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,________ |
(4)定量实验测定Ca和CaH2混合物中CaH2的质量分数。
①取m1 g样品与水完全反应,利用如图装置测定生成的气体体积时,在________时进行收集(填字母)。

a.刚开始有气泡
b.气泡连续均匀
c.气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数________(填“偏高”“偏低”或“无影响”)。
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(g)![]() 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等②单位时间生成amolA,同时消耗1.5molB;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2: 3: 2.
A. ⑤⑥⑧ B. ②⑤⑧ C. ①③④ D. ②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe 2 (SO 4 ) 3 和Al 2 (SO 4 ) 3 的混合溶液中,逐滴加入NaOH溶液至过量。下列图象中,能正确表示上述反应的是
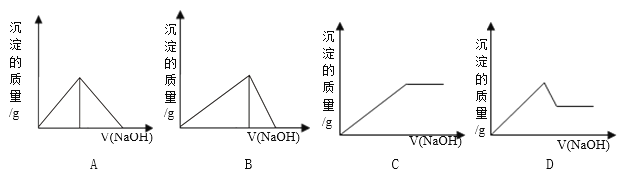
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是
选项 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | Cu(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ.mor1)的实验装罝如图所示。
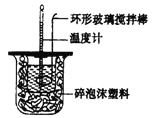
某兴趣小组的实验数值结果小于57.3 kJ/mol,原因可能是________(填字母)。
A.实验装罝保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4 溶液的温度
(2)利用氢气可以制取工业原料乙酸。己知:
A.CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ/mo1
B.C(s)+O2(g)=CO2(g) △H=-393.5kJ/mo1
C.H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是___________。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol 。
(3)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应 A: 4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
![]()
ⅱ.![]()
①写出此条件下反应A的热化学方程式是________________。
断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如图l所示的实验装置(固定装置已略去)。
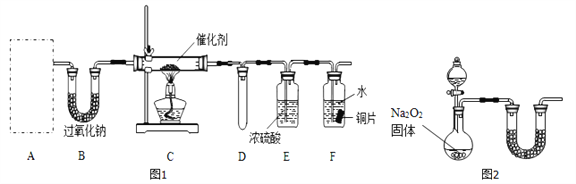
①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是______________;装置D的作用是____________。
③装置C中发生反应的化学方程式为_________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_______________。
⑤该装置存在的主要缺陷是____________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是______。
②实验室制备氨气的化学反应方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com