
【题目】电解原理在化学工业中有广泛应用。
(1)氯碱厂电解饱和食盐水制取烧碱,若利用下图装置制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
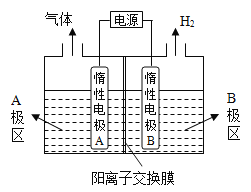
①B极区电解液为_____________溶液(填化学式),A极要连接电源的______________(填“正”或“负”)极。
②阳极电极反应式为_____________________________,电解过程中Na+向_____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
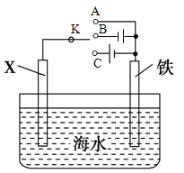
①若X为碳电极,为减缓铁的腐蚀,开关K应置于_____________处(填“A”、“B”或“C”)。
②若X为锌电极,开关K置于A处,该电化学防护法称为______________________________。
【答案】NaOH 正 2Cl—2e=Cl2↑ B 2Cl-+2H2O ![]() Cl2↑+H2↑+2OH- C 牺牲阳极的阴极保护法
Cl2↑+H2↑+2OH- C 牺牲阳极的阴极保护法
【解析】
(1)由图可知,右侧生成氢气,则B为阴极, B极区电解液为NaOH溶液, A极区中为NaCl溶液,氯离子放电生成氯气;
(2)结合原电池原理和电解池原理入手,保护金属的方法有牺牲阳极的阴极保护法和外加电流的阴极保护法;
(1)电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备NaOH,B极区电解液为NaOH溶液;Na+由A经过阳离子交换膜向B移动;A极区中为NaCl溶液,氯离子放电生成氯气,则阳极反应式为2Cl--2e-=Cl2↑。
①根据上述分析,B极区电解液为NaOH溶液,A极要连接电源的正极,故答案为NaOH;正;
②阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Na+向B电极迁移,故答案为2Cl--2e-=Cl2↑;B;
③电解总反应的离子方程式为2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-,故答案为2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)①若 X 为碳棒,若开关 K 置于A处,构成原电池,Fe为负极,加速Fe的腐蚀;若开关 K 置于B处,构成电解池,Fe为阳极,加速铁的腐蚀;若开关 K 置于C处,构成电解池,Fe为阴极,被保护,减缓铁的腐蚀,故答案为C;
②若 X 为锌,开关 K 置于A处,构成原电池,Zn为负极,Fe被保护,减缓铁的腐蚀,该方法为牺牲阳极的阴极保护法,故答案为牺牲阳极的阴极保护法。


科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2的反应热ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.化合反应都是放热反应
D.98%的浓硫酸和NaOH溶液反应生成1mol液态水时,反应热ΔH<-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是

A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是

A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.根据![]() 时的数据,可求出该温度下的平衡常数
时的数据,可求出该温度下的平衡常数
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
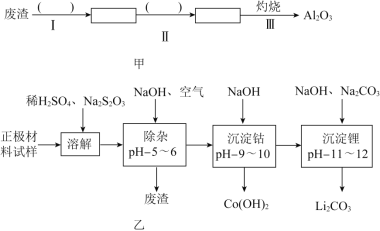
【题目】废旧锂离子电池的正极材料试样![]() 主要含有
主要含有![]() 及少量Al、Fe等
及少量Al、Fe等![]() 可通过下列实验方法回收钴、锂.
可通过下列实验方法回收钴、锂.
(1)在上述溶解过程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解过程中反应的离子方程式为 ______ .
在溶解过程中反应的离子方程式为 ______ .
沉淀物 | 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
(2)除杂时通入空气的目的 ______ ,所得的废渣成分为 ______ ![]() 从废渣中获得
从废渣中获得![]() 的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
(3)工业上,将![]() 粗品制备成高纯
粗品制备成高纯![]() 的部分工艺如图乙.
的部分工艺如图乙.
![]() 将
将![]() 溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
![]() 电解后向LiOH溶液中加入过量
电解后向LiOH溶液中加入过量![]() 溶液,过滤、烘干得高纯
溶液,过滤、烘干得高纯![]() .
.
①![]() 中,阴极的电极反应式是 ______ .
中,阴极的电极反应式是 ______ .
②![]() 中,生成
中,生成![]() 反应的化学方程式是 ______ .
反应的化学方程式是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是![]()
![]()
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
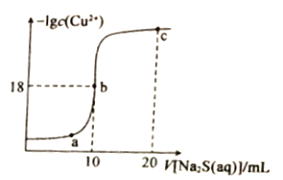
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用沉淀溶解平衡原理解释的是![]()
A.误食可溶性钡盐,用![]() 的硫酸钠溶液洗胃
的硫酸钠溶液洗胃
B.除去硫酸铜溶液中的铁离子,可加![]() ,调节pH
,调节pH
C.在AgI的沉淀体系中加硫化钠溶液,出现黑色沉淀
D.在配制![]() 溶液时,用稀盐酸溶解
溶液时,用稀盐酸溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的一种重要还原剂。一般的制备方法是将AlC13溶于有机溶剂,再把所得溶液滴加到NaH粉末上,可制得铝氢化钠。实验要求和装置如下,回答下列问题:
(1)制取铝氢化钠要在非水溶液中进行,主要原因是_______(用化学方程式表示)。用下列装置制取少量铝氢化钠(含副产物处理)较为合理的是__________。

(2)对于原料A1C13的制取,某兴趣小组设计了如下装置:
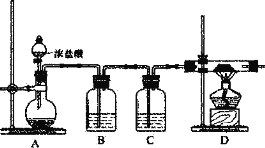
①连接好装置后,应进行的第一步操作是_________;为保证产物的纯净,应待D中__________(填现象)再加热酒精灯。
②B装置中盛装饱和NaCl溶液,实验开始后B中产生的现象是_________,选择饱和NaCl溶液的理由是_____。
③C装置的作用是_________;若无C装置,试预测实验后D中生成物除A1C13外可能还含有_________。(填化学式)
④上述装置存在的明显缺陷是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com