
【题目】下列事实不能用沉淀溶解平衡原理解释的是![]()
A.误食可溶性钡盐,用![]() 的硫酸钠溶液洗胃
的硫酸钠溶液洗胃
B.除去硫酸铜溶液中的铁离子,可加![]() ,调节pH
,调节pH
C.在AgI的沉淀体系中加硫化钠溶液,出现黑色沉淀
D.在配制![]() 溶液时,用稀盐酸溶解
溶液时,用稀盐酸溶解
【答案】A
【解析】
能用沉淀溶解平衡原理解释,说明存在难溶电解质的溶解平衡,且改变外界条件,平衡发生移动,以此解答该题。
A.硫酸根离子与钡离子反应为复分解反应,不属于沉淀的转化,故A不能用沉淀溶解平衡原理解释;
B.氢氧化铁的溶解度较小,加入氢氧化铜,可调节pH,利于生成氢氧化铁,存在沉淀的转化,故B能用沉淀溶解平衡原理解释;
C.在AgI的沉淀体系中加硫化钠溶液,出现黑色沉淀,说明生成溶解度更小的硫化银,存在沉淀的转化,故C能用沉淀溶解平衡原理解释;
D.在配制![]() 溶液时,用稀盐酸溶解,可抑制氢氧化铁的生成,防止溶液浑浊,与难溶电解质的溶解平衡有关,故D能用沉淀溶解平衡原理解释。
溶液时,用稀盐酸溶解,可抑制氢氧化铁的生成,防止溶液浑浊,与难溶电解质的溶解平衡有关,故D能用沉淀溶解平衡原理解释。
答案选A。


科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 酸性:H3PO4>HClO,因为 H3PO4 的非羟基氧原子数比 HClO 的多
C. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
D. 青蒿素分子式为 C15H22O5,结构见图,该分子中包含 7 个手性碳原子

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)氯碱厂电解饱和食盐水制取烧碱,若利用下图装置制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
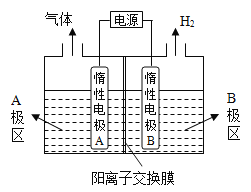
①B极区电解液为_____________溶液(填化学式),A极要连接电源的______________(填“正”或“负”)极。
②阳极电极反应式为_____________________________,电解过程中Na+向_____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
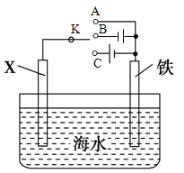
①若X为碳电极,为减缓铁的腐蚀,开关K应置于_____________处(填“A”、“B”或“C”)。
②若X为锌电极,开关K置于A处,该电化学防护法称为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13。下列说法不正确的是( )

A.在t℃时,AgI的Ksp=2.5×10-15 mol2.L-2
B.图中b点有碘化银晶体析出
C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点
D.在t℃时,反应AgBr(s)+I-(aq)![]() AgI(s)+Br-(aq)的平衡常数K=200
AgI(s)+Br-(aq)的平衡常数K=200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 用0.2000 molL-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 molL-1),当pH=7时,溶液中的酸恰好完全中和
D. 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 molL-1盐酸、③0.1 molL-1氯化镁溶液、④0.1 molL-1硝酸银溶液中,Ag+浓度:④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() ,
,![]() 的反应,一定是自发反应
的反应,一定是自发反应
B.向AgI悬浊液中加人某浓度的KCl溶液,黄色沉淀转化为白色沉淀,说明![]()
C.碘化铅是一种难溶于水的金黄色粉末,常温下碘化铅饱和溶液呈金黄色
D.在相同很度下,HF的![]() 的Ka,则等物质量浓度的NaF与CH3COOK溶液相比较,NaF溶液的pH大于
的Ka,则等物质量浓度的NaF与CH3COOK溶液相比较,NaF溶液的pH大于![]() 溶液的pH
溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
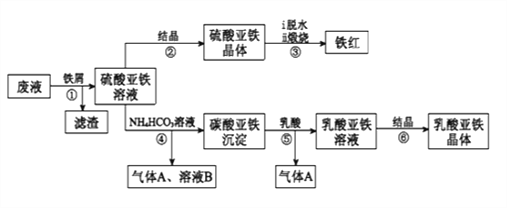
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子化合物A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层结构。请回答:
(1)试写出A的阳离子及阴离子的化学式________、________
(2)适当加热,A就分解为两种气体,其中一种气体是化合物,该反应的化学方程式为________。
(3)A溶于水后生成一种化合物和一种单质,则A的水溶液呈________性(酸/碱/中),原因:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/L某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的=c(H+)=1×10-11mol/L
C.该溶液中水的离子积常数为1×10-22
D.用pH=11的氢氧化钠溶液V1L与V2L0.1mol/L该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com