
【题目】离子化合物A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层结构。请回答:
(1)试写出A的阳离子及阴离子的化学式________、________
(2)适当加热,A就分解为两种气体,其中一种气体是化合物,该反应的化学方程式为________。
(3)A溶于水后生成一种化合物和一种单质,则A的水溶液呈________性(酸/碱/中),原因:________
【答案】NH4+ H- NH4H ![]() NH3↑+H2↑ 碱 NH4H+H2O=NH3·H2O+H2↑
NH3↑+H2↑ 碱 NH4H+H2O=NH3·H2O+H2↑
【解析】
根据题目的信息可知:NH5的所有原子的最外层都符合稳定结构,因此是铵根离子和氢离子,一个铵根离子带一个单位的正电荷,一个氢离子带一个单位的负电荷;根据质量守恒定律可知:NH5分解为氨气和氢气;A溶于水后生成一种化合物和一种单质,即NH5和水反应生成氨水和氢气,氨水显碱性。
(1)NH5的所有原子的最外层都符合稳定结构,因此是铵根离子和氢离子,一个铵根离子带一个单位的正电荷,一个氢离子带一个单位的负电荷,整个物质对外不显电性,阳离子及阴离子的化学符号为:NH4+;H-;
(2)根据质量守恒定律可知:NH5受热分解为氨气和氢气,反应的化学方程式为:NH4H ![]() NH3↑+H2↑;
NH3↑+H2↑;
(3)A溶于水后生成一种化合物和一种单质,即NH5和水反应生成氨水和氢气,氨水显碱性,化学方程式: NH5+H2O=NH3H2O+H2↑。


科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是

A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.根据![]() 时的数据,可求出该温度下的平衡常数
时的数据,可求出该温度下的平衡常数
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用沉淀溶解平衡原理解释的是![]()
A.误食可溶性钡盐,用![]() 的硫酸钠溶液洗胃
的硫酸钠溶液洗胃
B.除去硫酸铜溶液中的铁离子,可加![]() ,调节pH
,调节pH
C.在AgI的沉淀体系中加硫化钠溶液,出现黑色沉淀
D.在配制![]() 溶液时,用稀盐酸溶解
溶液时,用稀盐酸溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝水滑石(Mg2Al(OH)6ClxH2O)是一种人工合成的新材料.它在高温下完全分解MgO、Al2O3、HCl和水蒸气.用如图所示的装置进行实验以确定其化学式.完成下面小题。

【1】若只通过测定装置中C、D的增重来确定x,则装置按气流方向接口的连接顺序为
A.a→b→c→eB.a→c→b→dC.a→e→d→bD.a→d→e→c
【2】加热前通N2,称取C、D的初始质量后,再持续通N2。对通N2作用叙述错误的是
A.加热前通,为排尽装置中空气
B.持续通,为将产生的气体被C、D完全吸收
C.持续通,为防止倒吸
D.持续通,为防止MgO、Al2O3和氧气反应
【3】完全分解后测得C增重3.65g、D增重9.90g,则x的值是
A.2B.3C.4D.5
【4】若气体温度过高,则不易被液体充分吸收,冷却玻管B能降低气体的温度,但不能液化水蒸气。若取消B后进行实验,测定的x值将
A.偏低B.偏高C.无影响D.无法确定
【5】上述镁铝水滑石在空气中放置时易发生反应生成Mg2Al(OH)6Cl1﹣2y(CO3)yzH2O,该生成物也能发生类似的热分解反应,现以此物为样品,用上述装置和试剂进行实验测定z,除测定D的增重外,至少还需测定
A.样品的质量
B.装置C的增重
C.样品的质量和装置C的增重
D.样品分解后残余物质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属M的样品2.5g放入50g 19.6%的硫酸溶液中,恰好完全反应(样品中的杂质既不溶于硫酸,也不与其发生反应),生成硫酸盐。实验测知,此硫酸盐中硫、氧元素的质量分数之和为80 %。试求:
(1)原金属样品中,金属M的质量分数_____
(2)M的相对原子质量__________
(3)反应所得的硫酸盐溶液中溶质的质量分数___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的一种重要还原剂。一般的制备方法是将AlC13溶于有机溶剂,再把所得溶液滴加到NaH粉末上,可制得铝氢化钠。实验要求和装置如下,回答下列问题:
(1)制取铝氢化钠要在非水溶液中进行,主要原因是_______(用化学方程式表示)。用下列装置制取少量铝氢化钠(含副产物处理)较为合理的是__________。

(2)对于原料A1C13的制取,某兴趣小组设计了如下装置:
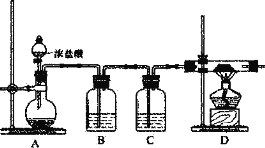
①连接好装置后,应进行的第一步操作是_________;为保证产物的纯净,应待D中__________(填现象)再加热酒精灯。
②B装置中盛装饱和NaCl溶液,实验开始后B中产生的现象是_________,选择饱和NaCl溶液的理由是_____。
③C装置的作用是_________;若无C装置,试预测实验后D中生成物除A1C13外可能还含有_________。(填化学式)
④上述装置存在的明显缺陷是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:___。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②海水中加熟石灰;③加盐酸;④过滤;⑤蒸发浓缩冷却结晶。其步骤先后顺序是___(步骤可重复使用),
(3)上述步骤①中“一定条件下”具体是指:___,其目的是___。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l012,当溶液中c(Mg2+)≤1.0×105mol·L1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥___mol·L1。
(5)将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解溶液变澄清。反应原理可能有两方面,请分别用离子方程式表示:
①____;
②____。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取___代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。其工作时正极的电极反应式:___;用此镁电池给铅蓄电池充电,下列说法中正确的是___。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24gMg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com