
| 起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
| 3 |
| 4 |
| 3 |
| 4 |
| 4 |
| 6 |
| 5 |
| 6 |


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
| A、当溶液中有Al3+生成时,溶液中可能存在:SO42-、NO3-、H+、Mg2+ |
| B、当溶液中有Al3+生成时,溶液中一定存在H+、SO42-,可能存在Mg2+ |
| C、当溶液中有AlO2-生成时,溶液中一定存在:OH-、Ba2+、NO3- |
| D、当溶液中有AlO2-生成时,溶液中可能存在:OH-、Ba2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
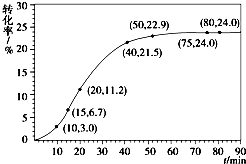 (1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化钙被还原 |
| B、水既是氧化剂,又是还原剂 |
| C、H2既是氧化产物,也是还原产物 |
| D、H2O发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com