
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、盐酸、纯碱、硫酸亚铁、生石灰 |
| B、硫酸、熟石灰、硝酸钾、五氧化二磷 |
| C、氢硫酸、消石灰、干冰、硫酸铜 |
| D、硝酸、苛性纳、碱式碳酸铜、熟石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:
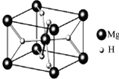 MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为
MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag?cm-3,则晶胞的体积为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | SO42-﹑NO3-﹑Cl- |
| 阳离子 | Fe3+﹑Fe2+﹑NH4+﹑Cu2+﹑Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始浓度( mol/L) | C(NH3) | C(O2) | C(NO) | C(H2O) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| B、充电时阴极电极反应式为:PbSO4+2e-=Pb+SO42- |
| C、充电时,若要使1mol PbSO4转变为Pb和PbO2,则需要通过2mol电子 |
| D、放电时,H+向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com