
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氧化铝熔点很高 | 制造耐火坩埚 |
C. | 硅有导电性 | 制造光导纤维 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A.A
B.B
C.C
D.D
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中可能大量共存的是( )
A.弱碱性溶液中:Na+、K+、Cl﹣、HCO3﹣
B.“84”消毒液中:SiO32﹣、CO32﹣、Na+、S2﹣
C.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
D.0.1 molL﹣1FeCl3溶液中:Fe2+、NH4+、SCN﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能源在使用时对环境无污染或污染很小,且可以再生的是
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能.
A. ①②③④ B. ⑤⑥⑦⑧ C. ①③⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12mol/L的盐酸(p=1.19g/㎝3)50mL稀释成6mol/L的盐酸(p=1.10g/㎝3),需加水的体积为
A.50mL B.50.5mL C.55mL D.59.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙烯中常混有少量的SO2,有人设计如下图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:

(1)能说明SO2存在的实验现象是__________________。
(2)使用装置b的目的是_________________________。
(3)使用装置c的目的是_________________________。
(4)能证明混合气体中含有乙烯的现象是___________。
(5)图中a、b、c、d装置盛放的试剂依次是____________(填序号)。
A.品红溶液 B. NaOH溶液 C.浓硫酸 D.酸性高锰酸钾溶液
书写B中发生的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, 将浓度均为0.1 mol/L、体积分别为Va 和Vb 的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。 下列说法正确的是
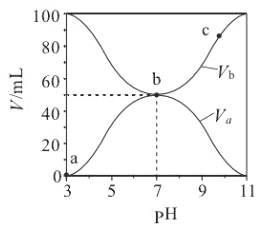
A. Ka(HA)的值与 Kb(BOH) 的值不相等 B. b 点时, 水电离出的 c(H+)=10-7mol/L
C. c 点时, c(A-) > c(B+) D. a→c 过程中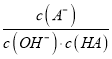 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g) ![]() CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:

已知:TON=![]()
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
弱酸 | 碳酸 | 次氯酸 |
电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol L-1 NaClO 溶液的 pH=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某同学对NaClO的物质组成和分类进行的分析,其中不正确的是( )
A.根据元素组成知道它是化合物
B.因为含有钠离子与氯离子和氧离子,所以该物质是盐
C.该物质可以称为钠盐也可以称为次氯酸盐
D.该物质有强氧化性,生活中可用作消毒剂和漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 下面列出了几组物质,请将物质的合适序号填写在空格上。
同位素___________;同系物____________;同分异构体___________。
①金刚石与石墨; ②D与T; ③12C和13C; ④O2与O3;
⑤CH4和CH3CH2CH3; ⑥CH2=CHCH3和CH2=CH2;

II.篮烷分子的键线式如图所示,试回答:

写出篮烷分子的化学式____________;篮烷分子的一氯取代物的种数为_______种。
III.在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)![]() N2O4(g) ,如图所示。
N2O4(g) ,如图所示。

(1)曲线_____________ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则______________中反应更快。
(3)在0到1 min中内用X表示该反应的速率是________,该反应达限度时,Y的转化率是_________,反应开始时与反应达平衡状态时的压强之比为______。
(4)若反应达平衡状态时再升高温度,容器内混合气体颜色加深,则正反应是_________反应(填“放热”或“吸热”。已知:降温有利于放热反应进行)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com