
【题目】25℃时, 将浓度均为0.1 mol/L、体积分别为Va 和Vb 的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。 下列说法正确的是
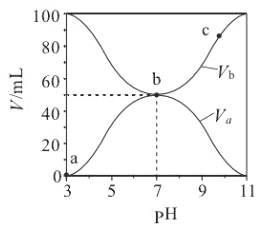
A. Ka(HA)的值与 Kb(BOH) 的值不相等 B. b 点时, 水电离出的 c(H+)=10-7mol/L
C. c 点时, c(A-) > c(B+) D. a→c 过程中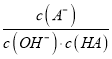 不变
不变
【答案】D
【解析】A、Ka(HA)=c(H+ )c(A―)/c(HA )=10―3×10―3/(0.1―10―3), PH=11时,c(OH― )=10―3,Kb(BOH) =c(OH― )c(B+ )/c(BOH )=10―3×10―3/(0.1―10―3),即Ka(HA)的值与 Kb(BOH) 的值相等,故A错误;B、从电离常数可以看出酸和碱都是弱电解质,对水的电离起促进作用, b 点时, 水电离出的 c(H+)>10-7mol/L,故B错误;C、 c 点时,碱过量, c(A-) < c(B+) ,故C错误;D、A―+H2O![]() HA+OH― ,反应的平衡常数
HA+OH― ,反应的平衡常数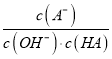 只要温度不变,值就不变,故D正确;故选D。
只要温度不变,值就不变,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】(2016天津)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质汽化或熔化时,所克服的微粒间的作用力属同种类型的是( )
A. 二氧化硅和生石灰的熔化 B. 碘和干冰的升华 C. 氯化钠和铁的熔化 D. 食盐和冰的熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
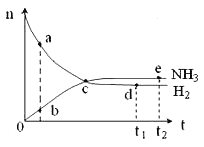
A. 点a的n(H2)和点b的n(NH3)比值为3∶2
B. 点 c处反应达到平衡
C. 点d (t1时刻)和点 e (t2时刻) 处n(N2)不一样
D. 其他条件不变,773K下反应至t1时刻,n(H2)比右图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与用途的对应关系不正确的是( )
选项 | 性质 | 用途 |
A. | 次氯酸有强氧化性 | 用作漂白剂 |
B. | 氧化铝熔点很高 | 制造耐火坩埚 |
C. | 硅有导电性 | 制造光导纤维 |
D. | 硫酸有酸性 | 用于金属加工前的酸洗 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等。回答下列问题:
(1)CO与H2分别与O2都可以设计成燃料电池。CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为:______________;
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。COS的电子式为___________;羰基硫与烧碱溶液反应生成水喝两种正盐的离子方程式为:__________;羰基硫的脱硫常用两种方法,其反应式分别为:
①氢解反应:COS(g) + H2(g) = H2S(g) + CO(g) ΔH1 =+7kJ/mol
②水解反应:COS(g) + H2O(g) = H2S(g) + CO2(g) ΔH2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
则ΔH2 =____________kJ/mol。
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2 =-90.14kJ/mol。该反应能自发的理由是_______
CH3OH(g)+H2O(g) ΔH2 =-90.14kJ/mol。该反应能自发的理由是_______
①一定温度下,在两个容积都为为VL的恒容莫比容器中,按如下方式加入反应物,一段时间后达到平衡:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、3a molH2、 n molCH3OH(g)、n molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为_____________;
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有:________(答两点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
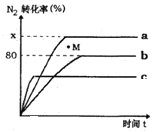
①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
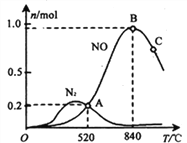
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
② 52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③ C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢
硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com