
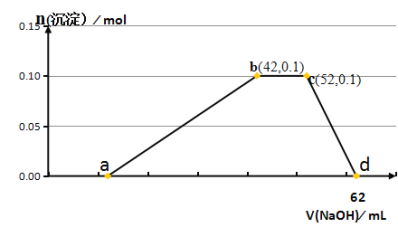
【题目】某研究小组取50g含十二水硫酸铝铵〔NH4Al(SO4)2·12H2O俗称铝铵矾〕的样品投入200mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示:
(假设铝铵矾中的杂质不溶于H2SO4,也不溶于NaOH)
请回答下列问题:
(1)cd段反应的离子方程式是___;
(2)图中b点溶液中的溶质有___;
(3)铝铵矾溶于水时的电离方程式是___;
(4)H2SO4的物质的量的浓度为___;
(5)该样品中铝铵矾的质量分数为___。
【答案】Al(OH)3+OH-=AlO![]() +2H2O Na2SO4、(NH4)2SO4 NH4Al(SO4)2=NH
+2H2O Na2SO4、(NH4)2SO4 NH4Al(SO4)2=NH![]() +Al3++2SO
+Al3++2SO![]() 0.3molL-1 90.6℅
0.3molL-1 90.6℅
【解析】
由图像可知,a点前是氢氧化钠和剩余的酸反应,a-b是铝离子和氢氧化钠产生0.1mol的氢氧化铝沉淀,b-c是铵根和10 mL氢氧化钠溶液反应产生氨水,c-d是0.1mol氢氧化铝和10 mL氢氧化钠溶液反应生成偏铝酸钠。
(1)由图像可知,cd段是0.1mol氢氧化铝和10 mL氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式是Al(OH)3+OH-=AlO![]() +2H2O,故答案为:Al(OH)3+OH-=AlO
+2H2O,故答案为:Al(OH)3+OH-=AlO![]() +2H2O;
+2H2O;
(2)由图像可知,b点时,铝离子刚好完全沉淀,溶液中剩余Na2SO4、(NH4)2SO4,故本题答案为:Na2SO4、(NH4)2SO4;
(3)铝铵矾是强电解质,全部电离,溶于水时的电离方程式为NH4Al(SO4)2=NH![]() +Al3++2SO
+Al3++2SO![]() ,故本题答案为:NH4Al(SO4)2=NH
,故本题答案为:NH4Al(SO4)2=NH![]() +Al3++2SO
+Al3++2SO![]() ;
;
(4)由c-d段可知,根据Al(OH)3+OH-=AlO![]() +2H2O,0.1mol氢氧化铝需要消耗0.1mol氢氧化钠溶液,则氢氧化钠浓度为:c=0.1mol/0.01L=10mol/L,a-b段产生0.1mol氢氧化铝,则需消耗氢氧化钠为0.3mol,氢氧化钠体积为:0.3mol/10mol/L=0.03L=30mL,则a点的值为12mL,a点前是氢氧化钠和硫酸按照2:1进行反应,则硫酸的物质的量为:
+2H2O,0.1mol氢氧化铝需要消耗0.1mol氢氧化钠溶液,则氢氧化钠浓度为:c=0.1mol/0.01L=10mol/L,a-b段产生0.1mol氢氧化铝,则需消耗氢氧化钠为0.3mol,氢氧化钠体积为:0.3mol/10mol/L=0.03L=30mL,则a点的值为12mL,a点前是氢氧化钠和硫酸按照2:1进行反应,则硫酸的物质的量为: 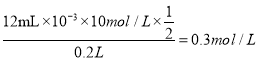 ,故H2SO4的物质的量的浓度为;0.3molL-1;
,故H2SO4的物质的量的浓度为;0.3molL-1;
(5)根据铝元素守恒,十二水硫酸铝铵〔NH4Al(SO4)2·12H2O的物质的量为0.1mol,则十二水硫酸铝铵的质量为45.3g,该样品中铝铵矾的质量分数为![]() ,故本题答案为:90.6%。
,故本题答案为:90.6%。


科目:高中化学 来源: 题型:
【题目】某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
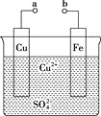
A. a和b不连接时,铁片上会有![]() 产生
产生
B. a和b用导线连接时,铁片上发生的反应为![]()
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 是阿伏加德罗常数的值,下列说法正确的是
A. 1mol葡萄糖分子含有的羟基数目为6NA
B. 5.8gC4H10中含有共价键总数为1.3NA
C. 5.8g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.04NA
D. 4.6g乙醇完全氧化成乙醛,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用莤烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如下:
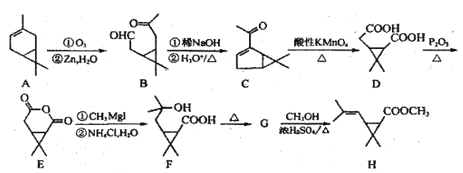
已知:R1CHO+R2CH2CHO
(1)写出一分子的 F 通过酯化反应生成环酯的结构简式__________。
(2)写出 G 到 H 反应的化学方程式___________。
(3)写出满足下列条件的 C 的一种同分异构体的结构简式______________。
①能与FeCl3 溶液发生显色反应;②分子中有 4 种不同化学环境的氢。
(4)写出以![]() 和 CH3CH2OH为原料制备
和 CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向![]() 溶液中逐滴滴入
溶液中逐滴滴入![]() 溶液,溶液的pH与
溶液,溶液的pH与![]() 溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
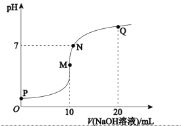
(1)用化学用语表示M点![]() 的原因__________。
的原因__________。
(2)![]() 四点中,水电离产生的
四点中,水电离产生的![]() 浓度最大的是______________点。
浓度最大的是______________点。
(3)下列关系中,正确的是________。
a P点![]()
b N点![]()
c Q点![]()
d ![]() 溶液中
溶液中![]() 小于
小于![]() 溶液中
溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩,如图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
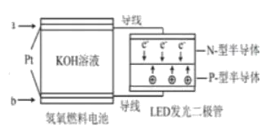
A.通入O2的电极发生反应:O2+4e-=2O2-
B.a处通入氧气,b处通氢气
C.电池放电后,OH-的物质的量浓度减小
D.电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+等)为原料制备氧化锌的流程如下:
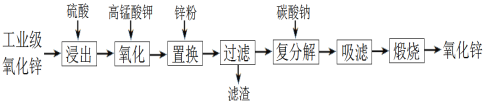
其中“氧化”加入KMnO4是为了除去浸出液中的Fe2+和Mn2+。下列有关说法错误的是
A. 浸出时通过粉碎氧化锌提高了浸出率
B. “氧化”生成的固体是MnO2和Fe(OH)3
C. “置换”加入锌粉是为了除去溶液中的Cu2+、Ni2+等
D. “煅烧”操作用到的仪器:玻璃棒、蒸发皿、泥三角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素在元素周期表中的位置:________________。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:
________CuSO4+_____PH3+_____H2O=_____Cu3P↓+_____H3PO4+_____H2SO4
(3)工业制备PH3的流程如图所示。

①次磷酸属于________元酸。
②白磷和烧碱溶液反应的化学方程式为:____________________________________。
③若起始时有1 mol P4参加反应,则整个工业流程中共生成________mol PH3。(不考虑产物的损失)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com