
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( ) 
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g),△H=﹣117kJmol﹣1
【答案】D
【解析】解:A、依据图象分析判断,Mg与Cl2的能量高于MgCl2,依据能量守恒判断,所以由MgCl2制取Mg是吸热反应,故A错误;
B、物质的能量越低越稳定,易图象数据分析,化合物的热稳定性顺序为:MgI2<MgBr2<MgCl2<MgF2,故B错误;
C、氧化性:F2>Cl2>Br2>I2,故C错误;
D、依据图象Mg(s)+Cl2(l)=MgCl2(s)△H=﹣641kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=﹣524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g)△H=﹣117KJmol﹣1,故D正确;
故选D.
A、依据图象分析判断,Mg与Cl2的能量高于MgCl2,据此分析;
B、物质能量越高越活泼,越不稳定;
C、氧化性:F2>Cl2>Br2>I2;
D、根据盖斯定律构建目标方程式书写.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的NaOH溶液滴定相同浓度的一元弱酸HA20mL,滴定过程中溶液的pH随滴定分数(滴定分数= ![]() ) 的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
) 的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
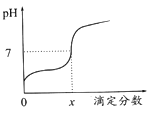
A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减少
B. 当滴定分数为1时,溶液中水的电离程度最大
C. 当滴定分数大于1时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)> c(H+)
D. 当滴定分数为x时,HA的电离常数为KHA=(10-7x)/(1-x)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中化学元素和化合物说法错误的是
A. 活细胞中,含量最多的元素是H
B. 鸟嘌呤和胞嘧啶数量越多的DNA分子越稳定
C. 氨基酸、多肽链和蛋白质一般都含有氨基和羧基
D. 构成淀粉、纤维素和糖原的单体都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。
|
|
|
|
|
|
|
| 0 |
第二 周期 | 3 锂 6.941 | 4 铍 9.012 | 5 硼 10.81 |
| 7 氮 14.01 | 8 氧 16.00 | 9 氟 19.00 | 10 氖 20.18 |
第三 周期 | 11 钠 22.99 |
24.31 | 13 铝 26.98 | 14 硅 28.09 |
30.97 | 16 硫 32.06 | 17 氯 35.45 | 18 氩 39.95 |
请结合上图的元素周期表回答下列问题:
(1)金属性最强的是_______,原子半径最小的是_______;(填元素符号)
(2)相对原子质量为30.97的元素属_______(填“金属”或“非金属”),位置![]() 中的元素原子核内的质子数为_______(填数值);
中的元素原子核内的质子数为_______(填数值);
(3)请画出位置![]() 中元素的离子结构示意图____________。
中元素的离子结构示意图____________。
(4)位置![]() 中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,
中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,![]() 该分子中所含化学键个数为___________。
该分子中所含化学键个数为___________。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,请写出它溶于烧碱溶液的离子反应方程式________________。
(6)由Na、H、S、O四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(7)科学家认为存在NH5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________,写出NH5的电子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸的叙述中,正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
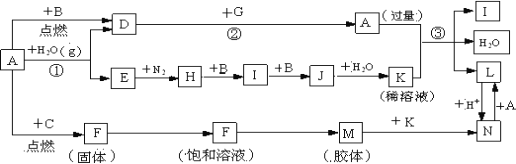
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式____________________。实验室引发该反应的操作___________。
(3)反应③离子方程式__________________________。
(4)H→I的化学方程式_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl﹣四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体. 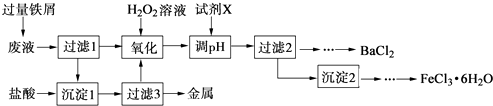
(1)沉淀1中含有的金属单质是 .
(2)氧化时加入H2O2溶液发生反应的离子方程式为 .
(3)下列物质中,可以作为试剂X的是 (填字母).
A.BaCl2
B.BaCO3
C.NaOH
D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是 .
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 .
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为、冷却结晶、、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: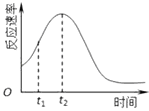
①;② .
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com