
| A、在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 |
| B、反应Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)在常温下不能自发进行,则△H<0 |
| C、工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 |
| D、在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、0.1mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32- | ||
| B、0.1mol/LFeCl3溶液:K+、NH4+、I-、SCN- | ||
| C、0.1mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1 |
| B、浓度均为0.1 mol?L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) |
| C、25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D、3.0L 0.1mol?L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢氟酸在玻璃上“刻字”:SiO2+4H++4F-═SiF4↑+2H2O |
| B、实验室制取氯气:2MnO4-+8H++6Cl-═2MnO2↓+3Cl2↑+4H2O |
| C、将铁粉放入硫酸铁和硫酸铜的混合溶液中,初始阶段发生的反应:Fe+2Fe3+═3Fe2+ |
| D、常温下,铁与过量的浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入少量的CH3COONa |
| B、向水中加入少量的NaHSO4 |
| C、向水中加入NaI并加热至100℃,pH=6 |
| D、向水中加少量的KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
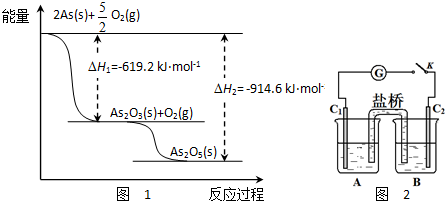
.
查看答案和解析>>
科目:高中化学 来源: 题型:
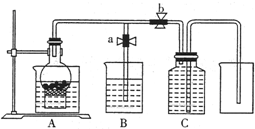 某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
|
最终溶液中的阳离子及其物质的量 | ||||
<
|
|||||
=
|
a mol Fe3+ | ||||
大于
|
|||||
=
|
a mol Fe2+ | ||||
>
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验仪器(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、酒精灯 | 溶液的浓缩结晶 |
| B | 蒸馏烧瓶、冷凝管、酒精灯 | 由工业酒精制无水酒精 |
| C | 天平、玻璃棒、胶头滴管、容量瓶 | 配制0.5mol?L-1的溶液100mL |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com