
【题目】聚苯乙烯(PS)和聚对苯二甲酸乙二醇酯(PET)材料具有高韧性、质轻、耐酸碱等性能,在生产生活中应用广泛。这两种聚合物可按图路线合成,请回答下列问题:

(1)A的分子式为_____,其核磁共振氢谱有_____组(个)吸收峰。
(2)含有苯环的B的同分异构体有_____种。
(3)D为苯乙烯,其结构简式为_____,官能团为_____。
(4)F的名称为_____,由E → G的反应类型是_____(填“缩聚”或“加聚”)反应。
(5)已知:![]() ,写出由Br-CH2CH2-Br制备HOOC-CH2CH2-COOH的合成路线:_____。
,写出由Br-CH2CH2-Br制备HOOC-CH2CH2-COOH的合成路线:_____。
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g)+I2(g)![]() 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C. 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B. 使温度都升高20℃后,两溶液的c(H+)均不变
C. 加水稀释2倍后,两溶液的c(H+)均增大
D. 加足量的锌充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数均为NA
B. 14.2g C10H22中含有共价键总数为3.1NA
C. 标准状况下,将3.36L Cl2通入1L 0.2mol/L FeBr2溶液中,被氧化的Br-数目为0.3NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)了解用药常识,有利于自我保健。现有下列药物:
A.阿司匹林(乙酰水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是____________。(填字母)
②治疗胃酸过多,但患有严重的胃溃疡,应该选择___________。(填字母)
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是____________。(填字母)
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是___________。(填字母)
(2)防治环境污染,改善生态环境已成为全球的共识。
①今年入冬以来,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是_______(填字母)。
A.SO2 B.NO2 C.PM2.5
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________ (填字母)标志的垃圾筒内。

③工业废水需处理达标后才能排放。下列废水处理的方法合理的是____________。
A.用中和法除去废水中的酸
B.用混凝剂除去废水中的重金属离子
C.用氯气除去废水中的悬浮物
(3)全世界每年因钢铁锈蚀造成大量的损失。某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验。
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为______的试管中铁钉锈蚀速度最慢。
②下列防止钢铁锈蚀的措施不合理的是__________(填字母)。
A.在自行车的钢圈表面镀镍
B.在地下钢铁管道上连接铜块
C.改变金属内部结构制成不锈钢
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:铁锅的腐蚀主要是由__________________腐蚀造成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜、铟、镓、硒等化合物。
(1)镓的基态原子的价电子排布式是___________。
(2)已知硒为第4周期ⅥA族元素,则硒与其相邻的同周期元素中,第一电离能从大到小顺序为___(用元素符号表示)。
(3)气态SeO3分子的立体构型为_____________________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为______;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为_______;
(7)一种铜金合金晶体具有面心立方最密堆积的结构.在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为______,若Au的原子半径为a pm,Cu的原子半径为b pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=6HCl+N2。下列说法错误的是( )
A.若管道漏气,遇氨就会产生白烟
B.该反应属于复分解反应
C.该反应属于氧化还原反应
D.该反应中Cl2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带 为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中), 得到海带灰悬浊液,然后按以下实验流程提取单质碘:
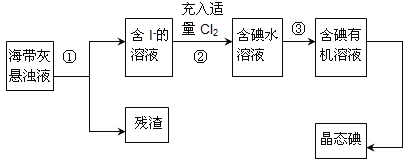
(1)指出提取碘的过程中有关的实验操作名称:①_______,③_______。
(2)操作③中所用的有机试剂可以是________(填序号)A.四氯化碳 B.乙醇,简述选择其理由________。
(3)操作过程③可以分解为如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液;
B.把50mL碘水和15mL 有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.静置、分层。
F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
G.旋开活塞,用烧杯接收下层溶液;
H.从分液漏斗上口倒出上层液体;
①上述F步操作的目的是:____;
②最后碘的有机溶液是通过_____获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出其错误之处并加以改正_____。
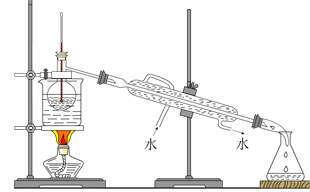
(5)进行上述蒸馏操作时,使用水浴的原因是 _______,最后晶态碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2及HI为原料来合成。请回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)===CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:

则该反应的△H=___________kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。

①0~5min内,用CO表示的平均反应速率为___________。
②既能加快反应速率,又能提高氢气转化率的措施有___________(答一条即可)。
③能说明上述反应已达化学平衡状态的是___________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体密度保持不变
C.反应容器内压强保持不变
D.混合气体的平均摩尔质量不变
(3)PbI2可由Pb3O4和HI反应制备,反应的化学方程式为___________。
(4)常温下PbI2饱和溶液中c(I-)=2.0×10-3mol·L-1,则Ksp(PbI2)=___________;已知Ksp(PbS)=4.0×10-28,则反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的平衡常数K=___________。
PbS(s)+2I-(aq)的平衡常数K=___________。
(5)HI的分解反应曲线和液相法制备HI的反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)![]() 2HI(g)的△H___________(填“>”或“<")0。
2HI(g)的△H___________(填“>”或“<")0。
②将SO2通入碘水中会发生反应:SO2+I2+2H2O===4H++SO42-+2I-,I2+I-![]() I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com