
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2及HI为原料来合成。请回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)===CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:

则该反应的△H=___________kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。

①0~5min内,用CO表示的平均反应速率为___________。
②既能加快反应速率,又能提高氢气转化率的措施有___________(答一条即可)。
③能说明上述反应已达化学平衡状态的是___________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体密度保持不变
C.反应容器内压强保持不变
D.混合气体的平均摩尔质量不变
(3)PbI2可由Pb3O4和HI反应制备,反应的化学方程式为___________。
(4)常温下PbI2饱和溶液中c(I-)=2.0×10-3mol·L-1,则Ksp(PbI2)=___________;已知Ksp(PbS)=4.0×10-28,则反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的平衡常数K=___________。
PbS(s)+2I-(aq)的平衡常数K=___________。
(5)HI的分解反应曲线和液相法制备HI的反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)![]() 2HI(g)的△H___________(填“>”或“<")0。
2HI(g)的△H___________(填“>”或“<")0。
②将SO2通入碘水中会发生反应:SO2+I2+2H2O===4H++SO42-+2I-,I2+I-![]() I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
【答案】-12 0.12molL-1·min-1 加压(或增大CO的浓度) CD Pb3O4+8HI=3PbI2+I2+4H20 4.0×10-9 1.0×1019 < I3-
【解析】
(1)根据CH3OH(g)+NH3(g)===CH3NH2(g)+H2O(g) △H=反应物的键能之和-生成物的键能之和来计算。
(2)①根据速率之比等于化学计量数之比,推出v(CH3OH)=v(CO),从而求出v(CO)。
②提高氢气转化率要使平衡右移。
③A.如果是2v正(CO)=v逆(H2),可以说明反应达到平衡状态。
B.该反应体系中气体的密度始终不变,不能根据密度判断平衡状态。
C.反应前后气体分子数目不等,故反应容器内压强保持不变,可以说明反应达到平衡状态。
D. 混合气体的平均摩尔质量=气体总质量/气体的总物质的量,总质量是一定的,反应前后气体分子数目不等,气体总物质的量如果不变,混合气体的平均摩尔质量就不变,所以混合气体的平均摩尔质量不变可以说明反应达到平衡状态。
(3)PbI2可由Pb3O4和HI反应制备,同时生成I2,Pb元素化合价从8/3价变为+2价,I元素化合价从-1价变为0价,根据电荷守恒、质量守恒配平。
(4)Ksp(PbI2)=c(Pb2+) c2(I-)=1.0×10-3× (2.0×10-3)2=4.0×10-9,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的平衡常数K= c2(I-)/ c(S2-)= [Ksp(PbI2)/ c(Pb2+)]/[ Ksp(PbS)/ c(Pb2+)]=4.0×10-9/4.0×10-28=1.0×1019。
PbS(s)+2I-(aq)的平衡常数K= c2(I-)/ c(S2-)= [Ksp(PbI2)/ c(Pb2+)]/[ Ksp(PbS)/ c(Pb2+)]=4.0×10-9/4.0×10-28=1.0×1019。
(5)①升温,HI的物质的量减少,即平衡左移,所以正反应为放热反应,△H<0。
②根据SO2+I2+2H2O===4H++SO42-+2I-,I2+I-![]() I3-得,随着n(I2)/ n(SO2)的增大,n(H+)和n(SO42-)保持不变,而n(I3-)增大,所以b所代表的微粒是I3-。
I3-得,随着n(I2)/ n(SO2)的增大,n(H+)和n(SO42-)保持不变,而n(I3-)增大,所以b所代表的微粒是I3-。
(1)CH3OH(g)+NH3(g)===CH3NH2(g)+H2O(g) △H=反应物的键能之和-生成物的键能之和=(351+393-463-293)KJ/mol=-12 KJ/mol,故答案为:-12。
(2)①CO(g)+2H2(g)![]() CH3OH(g),速率之比等于化学计量数之比,所以v(CH3OH)=v(CO)=0.6mol/L/5min=0.12molL-1·min-1,故答案为:0.12molL-1·min-1。
CH3OH(g),速率之比等于化学计量数之比,所以v(CH3OH)=v(CO)=0.6mol/L/5min=0.12molL-1·min-1,故答案为:0.12molL-1·min-1。
②提高氢气转化率要使平衡右移,既能加快反应速率,又能提高氢气转化率的措施有加压(或增大CO的浓度),故答案为:加压(或增大CO的浓度)。
③A.如果是2v正(CO)=v逆(H2),可以说明反应达到平衡状态,故A错误;
B.该反应体系中气体的密度始终不变,不能根据密度判断平衡状态,故B错误;
C.反应前后气体分子数目不等,故反应容器内压强保持不变,可以说明反应达到平衡状态,故C正确;
D. 混合气体的平均摩尔质量=气体总质量/气体的总物质的量,总质量是一定的,反应前后气体分子数目不等,气体总物质的量如果不变,混合气体的平均摩尔质量就不变,所以混合气体的平均摩尔质量不变可以说明反应达到平衡状态,故D正确。
故选CD。
(3)PbI2可由Pb3O4和HI反应制备,同时生成I2,Pb元素化合价从8/3价变为+2价,I元素化合价从-1价变为0价,根据电荷守恒、质量守恒配平可得反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H20,故答案为:Pb3O4+8HI=3PbI2+I2+4H20。
(4)Ksp(PbI2)=c(Pb2+) c2(I-)=1.0×10-3× (2.0×10-3)2=4.0×10-9,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的平衡常数K= c2(I-)/ c(S2-)= [Ksp(PbI2)/ c(Pb2+)]/[ Ksp(PbS)/ c(Pb2+)]=4.0×10-9/4.0×10-28=1.0×1019,故答案为:4.0×10-9 ;1.0×1019。
PbS(s)+2I-(aq)的平衡常数K= c2(I-)/ c(S2-)= [Ksp(PbI2)/ c(Pb2+)]/[ Ksp(PbS)/ c(Pb2+)]=4.0×10-9/4.0×10-28=1.0×1019,故答案为:4.0×10-9 ;1.0×1019。
(5)①升温,HI的物质的量减少,即平衡左移,所以正反应为放热反应,△H<0,故答案为:<。
②根据SO2+I2+2H2O===4H++SO42-+2I-,I2+I-![]() I3-得,随着n(I2)/ n(SO2)的增大,n(H+)和n(SO42-)保持不变,而n(I3-)增大,所以b所代表的微粒是I3-,故答案为:I3-。
I3-得,随着n(I2)/ n(SO2)的增大,n(H+)和n(SO42-)保持不变,而n(I3-)增大,所以b所代表的微粒是I3-,故答案为:I3-。


科目:高中化学 来源: 题型:
【题目】聚苯乙烯(PS)和聚对苯二甲酸乙二醇酯(PET)材料具有高韧性、质轻、耐酸碱等性能,在生产生活中应用广泛。这两种聚合物可按图路线合成,请回答下列问题:

(1)A的分子式为_____,其核磁共振氢谱有_____组(个)吸收峰。
(2)含有苯环的B的同分异构体有_____种。
(3)D为苯乙烯,其结构简式为_____,官能团为_____。
(4)F的名称为_____,由E → G的反应类型是_____(填“缩聚”或“加聚”)反应。
(5)已知:![]() ,写出由Br-CH2CH2-Br制备HOOC-CH2CH2-COOH的合成路线:_____。
,写出由Br-CH2CH2-Br制备HOOC-CH2CH2-COOH的合成路线:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 常温常压,两种气体的密度之比等于摩尔质量之比
B. 在同温同体积下,两种气体的物质的量之比等于压强之比
C. 在标准状况下,两种气体的体积之比等于摩尔质量之比
D. 在同温同压下,同体积的两种气体的质量之比等于摩尔质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中原子序数依次增大的前四周期元素。A与B同周期,且A元素原子核外s能级有1个未成对电子;B元素的原子核外p电子比s电子少1;C元素的原子序数比B元素多1;D元素的原子价电子有6个未成对电子,它的一种化合物常用于检验酒驾;E元素的原子价电子有4个未成对电子。请回答下列问题:
(1)第一电离能介于A和B之间的同周期元素有___________(填元素符号)。
(2)B元素的最高价氧化物的水化物在水溶液中能完全电离,电离所得阴离子的空间构型为______。写出2种与该阴离子互为等电子体的微粒的化学式:_____。画出基态D原子的价电子排布图:_____。
(3)C元素对应的简单氢化物的沸点明显高于同族其他元素对应的简单氢化物,其原因是___________。
(4)元素D可以形成的配合物如图所示。
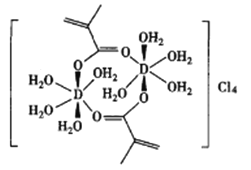
①该配合物中碳原子的杂化类型为___________。
②该配合物中所含化学键的类型不包括___________(填字母)。
a.极性共价键 b.非极性共价键 c.配位键 d.离子键 e.金属键 f.σ键 g.π键
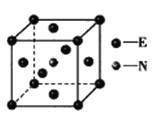
(5)元素E的单质和氮气在640℃可发生置换反应产物之一的晶胞结构如图所示,该反应的化学方程式为___。若该晶体的密度是ρg·cm-3,则两个最近的E原子间的距离为___________cm。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由物质a为原料,制备物质d(金刚烷)的合成路线如下图所示。关于图中有机物说法中正确的是

A. 物质a与物质b互为同系物
B. 物质d的一氯代物有2种
C. 物质c的分子式为C10H14
D. 物质a中所有原子一定在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A.甲:物质中的粒子数;乙:阿伏加德罗常数
B.甲:标准状况下的气体摩尔体积;乙:标准状况下的气体的体积
C.甲:固体的体积;乙:固体的密度
D.甲:溶液中溶质的物质的量浓度;乙:溶液体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com