
【题目】由物质a为原料,制备物质d(金刚烷)的合成路线如下图所示。关于图中有机物说法中正确的是

A. 物质a与物质b互为同系物
B. 物质d的一氯代物有2种
C. 物质c的分子式为C10H14
D. 物质a中所有原子一定在同一个平面上
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带 为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中), 得到海带灰悬浊液,然后按以下实验流程提取单质碘:
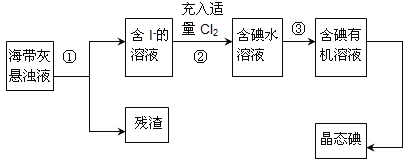
(1)指出提取碘的过程中有关的实验操作名称:①_______,③_______。
(2)操作③中所用的有机试剂可以是________(填序号)A.四氯化碳 B.乙醇,简述选择其理由________。
(3)操作过程③可以分解为如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液;
B.把50mL碘水和15mL 有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.静置、分层。
F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
G.旋开活塞,用烧杯接收下层溶液;
H.从分液漏斗上口倒出上层液体;
①上述F步操作的目的是:____;
②最后碘的有机溶液是通过_____获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出其错误之处并加以改正_____。
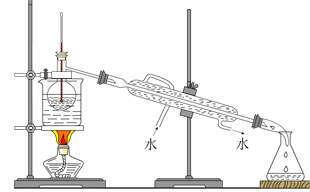
(5)进行上述蒸馏操作时,使用水浴的原因是 _______,最后晶态碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2及HI为原料来合成。请回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)===CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:

则该反应的△H=___________kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。

①0~5min内,用CO表示的平均反应速率为___________。
②既能加快反应速率,又能提高氢气转化率的措施有___________(答一条即可)。
③能说明上述反应已达化学平衡状态的是___________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体密度保持不变
C.反应容器内压强保持不变
D.混合气体的平均摩尔质量不变
(3)PbI2可由Pb3O4和HI反应制备,反应的化学方程式为___________。
(4)常温下PbI2饱和溶液中c(I-)=2.0×10-3mol·L-1,则Ksp(PbI2)=___________;已知Ksp(PbS)=4.0×10-28,则反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的平衡常数K=___________。
PbS(s)+2I-(aq)的平衡常数K=___________。
(5)HI的分解反应曲线和液相法制备HI的反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)![]() 2HI(g)的△H___________(填“>”或“<")0。
2HI(g)的△H___________(填“>”或“<")0。
②将SO2通入碘水中会发生反应:SO2+I2+2H2O===4H++SO42-+2I-,I2+I-![]() I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止,煤、石油和天然气等化石能源仍然是人类使用的主要能源。下列有关煤、石油、天然气等资源的说法正确的是
A. 石油裂解可以得到汽油,这种汽油是一种纯净物
B. 煤的气化就是将煤在高温条件由固态转化为气态的变化过程
C. 天然气是一种清洁的化石燃料
D. 煤就是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________(填仪器名称);需要量取98%浓硫酸____________mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(___________)。
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是____(填序号);
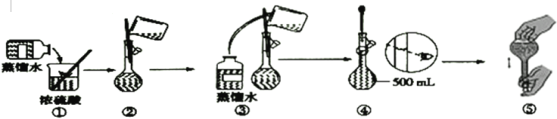
(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是___;
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入________mL 4.6mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100.0 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到16.84g沉淀,用过量稀硝酸处理后沉淀质量减少至6.99g,同时溶液中有气泡产生。试求:
(1)原混合液中Na2SO4的物质的量浓度为_____;
(2)产生的气体在标准状况下的体积为多少__________?(要求写出计算过程,只写结果不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是()
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氢气与氯气的的反应生产盐酸。
若一定量氢气在氯气中燃烧,所得混合物用100mL 3.0mol/L NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含NaClO的物质的量为0.0500mol。
(1)写出氯气与氢氧化钠溶液反应的化学方程式______________________。
(2)原NaOH溶液的质量分数为_____________________________。(保留三位小数)
(3)所得溶液中Cl-的物质的量为____________________________。
(4)求所用氯气和参加反应的氢气的物质的量之比____________________________。(写出计算过程)
(5)若将H2和Cl2充分混合后,在光照条件下会发生爆炸。现取一份H2和Cl2组成的混合气体经光照充分反应后,通入1000mL 0.1mol/L的NaOH溶液中,如图表示某种离子的物质的量随通入气体的体积变化曲线。当n=0.02mol时,光照前的混合气体中H2和Cl2的物质的量之比为________(已知HClO为弱酸,在水中主要以分子形式存在)
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质间的转化关系,其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物,其中A常温下呈液态;B和E为能产生温室效应的气体,且1mol E中含有10mol电子。乙和丁为黑色固体,将他们混合后加热发现固体由黑变红。

(1)写出化学式:甲______;乙______;丙______;
(2)丁的摩尔质量______;
(3)写出丙和E反应生成A和B的化学方程式___________;
(4)有同学将乙和丁混合加热后收集到的标准状态下气体4.48L,测得该气体是氢气密度的16倍,若将气体通入足量澄清石灰水,得到白色沉淀物___g;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com