
【题目】有关CuSO4的说法不正确的是( )
A.固体为白色B.溶液为蓝色
C.CuSO4溶液能杀菌D.CuSO4·5H2O能作干燥剂
科目:高中化学 来源: 题型:
【题目】(1)了解用药常识,有利于自我保健。现有下列药物:
A.阿司匹林(乙酰水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①可治疗支气管哮喘,但不宜过多服用的药物是____________。(填字母)
②治疗胃酸过多,但患有严重的胃溃疡,应该选择___________。(填字母)
③一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是____________。(填字母)
④能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是___________。(填字母)
(2)防治环境污染,改善生态环境已成为全球的共识。
①今年入冬以来,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是_______(填字母)。
A.SO2 B.NO2 C.PM2.5
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________ (填字母)标志的垃圾筒内。

③工业废水需处理达标后才能排放。下列废水处理的方法合理的是____________。
A.用中和法除去废水中的酸
B.用混凝剂除去废水中的重金属离子
C.用氯气除去废水中的悬浮物
(3)全世界每年因钢铁锈蚀造成大量的损失。某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验。
实验序号 | Ⅰ | Ⅱ | Ⅲ |
实验内容 |
|
|
|
请回答:
①在一周的观察过程中,他发现实验序号为______的试管中铁钉锈蚀速度最慢。
②下列防止钢铁锈蚀的措施不合理的是__________(填字母)。
A.在自行车的钢圈表面镀镍
B.在地下钢铁管道上连接铜块
C.改变金属内部结构制成不锈钢
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:铁锅的腐蚀主要是由__________________腐蚀造成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
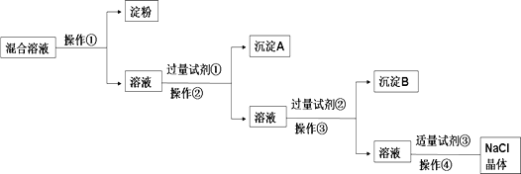
(1)写出上述实验过程中所用试剂:试剂①____;试剂③____。
(2)判断试剂①已过量的方法是:_____。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉___(填“能”或“不能”)透过半透膜。
(4)操作④的名称是____,其中玻璃棒的作用是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ·mol-1,②2NO(g)+O2(g)===2NO2(g) ΔH=-113.0 kJ·mol-1。下列热化学方程式正确的是
A. NO2(g)+SO2(g) ![]() SO3(s)+NO(g) ΔH=-41.8 kJ·mol-1
SO3(s)+NO(g) ΔH=-41.8 kJ·mol-1
B. SO3(g)+NO(g) ![]() NO2(g)+SO2(g) ΔH=+41.8 kJ·mol-1
NO2(g)+SO2(g) ΔH=+41.8 kJ·mol-1
C. NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-77.4 kJ·mol-1
SO3(g)+NO(g) ΔH=-77.4 kJ·mol-1
D. NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-183.6 kJ·mol-1
SO3(g)+NO(g) ΔH=-183.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2及HI为原料来合成。请回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)===CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:

则该反应的△H=___________kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下,向体积为2L的密闭容器中加人CO和H2,5min末反应达到化学平衡状态,测得各组分浓度如下表所示。

①0~5min内,用CO表示的平均反应速率为___________。
②既能加快反应速率,又能提高氢气转化率的措施有___________(答一条即可)。
③能说明上述反应已达化学平衡状态的是___________(填字母)。
A.v正(CO)=2v逆(H2)
B.混合气体密度保持不变
C.反应容器内压强保持不变
D.混合气体的平均摩尔质量不变
(3)PbI2可由Pb3O4和HI反应制备,反应的化学方程式为___________。
(4)常温下PbI2饱和溶液中c(I-)=2.0×10-3mol·L-1,则Ksp(PbI2)=___________;已知Ksp(PbS)=4.0×10-28,则反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的平衡常数K=___________。
PbS(s)+2I-(aq)的平衡常数K=___________。
(5)HI的分解反应曲线和液相法制备HI的反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g)![]() 2HI(g)的△H___________(填“>”或“<")0。
2HI(g)的△H___________(填“>”或“<")0。
②将SO2通入碘水中会发生反应:SO2+I2+2H2O===4H++SO42-+2I-,I2+I-![]() I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
I3-。图2中曲线b所代表的微粒是___________(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值。下列的说法中,正确的是( )
A. 4.6g金属钠由原子完全变为Na+ 离子时,失去的电子数为0.1NA
B. NA 个氧气分子与NA 个氢气分子的质量比为8︰1
C. 0.2 NA个硫酸分子与19.6g磷酸(相对分子质量:98)含有相同的氧原子数
D. 22.4L的氮气所含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________(填仪器名称);需要量取98%浓硫酸____________mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(___________)。
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是____(填序号);
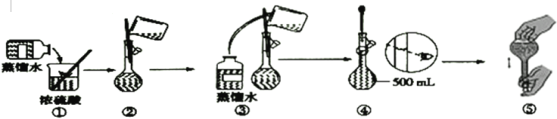
(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是___;
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入________mL 4.6mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值。下列说法正确的是
A. 1.0molCH4与3.0molCl2光照下反应生成的CHCl3分子数为1.0NA
B. 1.0mol·L-1的(NH4)3PO4溶液中阳离子数为3.0NA
C. 5.6gFe与过量浓盐酸完全反应转移的电子数为0.2NA
D. 常温下2.24LSO3中含有的质子数为4.0NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com