
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
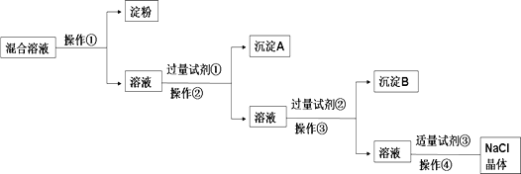
(1)写出上述实验过程中所用试剂:试剂①____;试剂③____。
(2)判断试剂①已过量的方法是:_____。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉___(填“能”或“不能”)透过半透膜。
(4)操作④的名称是____,其中玻璃棒的作用是____。
【答案】BaCl2 稀盐酸 取少量上层清液于试管中,再滴加少量BaCl2溶液,若无白色沉淀生成,则已经过量 不能 蒸发结晶 搅拌
【解析】
胶体不能透过半透膜,操作①为渗析,将淀粉与溶液分离,除去Na2SO4、CaCl2,可分别加入BaCl2、Na2CO3,除去粗盐中含有的Ca2+、SO42-可溶性杂质的方法:加入过量BaCl2,去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2,操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3,操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3,最后蒸发结晶可得到NaCl晶体,
(1)由以上分析可知试剂①为BaCl2,试剂③为盐酸;
故答案为:BaCl2;盐酸;
(2)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量;
故答案为:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;
(3)胶体粒子和浊液粒子半径比较大,不能透过半透膜,而溶液中溶质粒子可通过半透膜;
故答案为:不能;
(4)操作④由溶液得到晶体,为蒸发结晶操作,其中会使用玻璃棒搅拌来加速蒸发;
故答案为:蒸发结晶;搅拌。


科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验,三组实验均各取相同物质的量的盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见表:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
生成气体/mL | 280 | 336 | 336 |
请回答下列问题:
(1)要算出盐酸的物质的量,题中作为计算依据的数据是___,求得的盐酸的溶质物质的量为___;
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是___,求得请务必写出计算过 程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,增大反应物的浓度能增大反应速率的原因是
A. 单位体积内分子数增多 B. 单位体积内活化分子数增多
C. 活化分子百分数增大 D. 单位体积内有效碰撞的次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备丙烯的方法有多种,具体如下(本题丙烯用C3H6表示):
(1)丙烷(C3H8)脱氢制备丙烯(C3H6)
由下图可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性电极电解CO2的酸性溶液可得丙烯(C3H6),其原理如下图所示。则b的电极反应式为__________。

(3)以丁烯(C4H8)和乙烯(C2H4)为原料反应生成丙烯(C3H6)的方法被称为“烯歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定温度下,在一体积恒为VL的密闭容器中充入一定量的C4H8和C2H4,发生烯烃歧化反应。
I.该反应达到平衡的标志是______________
a.反应速率满足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物质的量之比为1:1:2
c.混合气体的平均相对分子质量不再改变
d.C4H8、C2H4、C3H6的浓度均不再变化
Ⅱ.已知t1min时达到平衡状态,测得此时容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡时C3H6的体积分数为![]() 。
。
①该时间段内的反应速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反应的平衡常数K=______________。
③t1min时再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一种生产丙烯的方法,但生产过程中伴有生成乙烯的副反应发生,具体反应如下:主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
①从产物的纯度考虑,丙烯和乙烯的质量比越高越好。则从下表现的趋势来看,下列反应条件最适宜的是__________(填字母序号)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下图中,平衡体系中丙烯的百分含量随压强增大呈上升趋势,从平衡角度解释其可能的原因是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
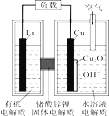
A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用于提纯或分离物质的方法有:A.萃取 B.冷却结晶 C.蒸发结晶 D.分液 E.蒸馏 F.过滤 G.加热等,请将提纯或分离的序号填在后面横线上。
(1)分离氯化钠固体和碘固体的混合物____。
(2)从含少量KCl的KNO3溶液中提取KNO3___。
II.通过蒸馏除去自来水中含有的氯离子等杂质制取纯净水,如图所示:
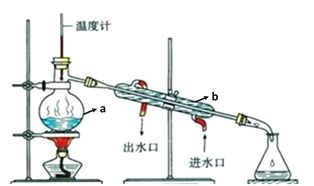
(1)写出下列仪器的名称:a____b_____
(2)仪器a中常加入少量___,这样做的目的是____。
(3)在进行实验操作前,应先___(a.点燃酒精灯;b.通冷凝水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 常温下,1.12 L丙烷分子中所含非极性键数目为0.1NA
B. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数为0.3NA
C. 0.1mol葡萄糖分子中官能团的数目为0.6NA
D. 溶解了1mol Cl2的新制氯水中,HClO、Cl-、ClO-粒子数之和为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com