
【题目】观察以下有机物结构
①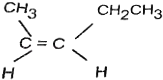 ,②
,②![]() ,③
,③![]()
(1)①②③中最多有几个原子共面?①________,②_________,③__________;
(2)②③中最多有几个原子共线?②__________,③___________ 。
【答案】9 6 18 3 6
【解析】
根据甲烷是正四面体结构、乙烯是平面型结构、乙炔是直线型结构、苯是平面型结构分析解答。
(1) ①中碳碳双键是平面结构,取代乙烯中氢原子的碳一定在同一平面内,最右边的甲基上的碳和一个氢也可能在同一平面内;左侧甲基上的一个氢也可能在同一平面内,所以,最多有9个碳原子共面;②中碳碳三键是直线形结构,最右边的甲基上的碳和一个氢在一个面内,所以共面的原子最多为6个;③中苯环基团上至少有12个原子共面,乙炔基上4个原子都在这个面上,右面的乙烯基上的原子都有可能在这个面上,所最多有18个原子共面;故答案为:9;6;18;
(2) ②中乙炔是直线形分子,取代乙炔中氢原子的碳在同一直线上,所以,共线的原子为3个;③中乙炔是直线形分子,根据苯环的特征,苯环最左边的碳和最左边的氢也在直线上,所以,共线的原子为6个。故答案为:3;6。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图为摇摆电池![]() 的工作原理图,在充放电过程中,
的工作原理图,在充放电过程中,![]() 在两极之间“摇来摇去”,其总反应为:
在两极之间“摇来摇去”,其总反应为:![]() ,下列有关说法正确的是
,下列有关说法正确的是
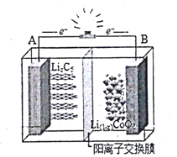
A.放电时,负极反应![]()
B.充电时,A极发生氧化反应
C.充电时,![]() 穿过隔离膜向B极移动
穿过隔离膜向B极移动
D.当B极失去xmol电子,电池消![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
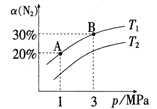
A.将1molN2与3molH2置于1L密闭容器中充分反应,放出的热量为92.3kJ
B.T1<T2
C.平衡状态由A变到B时,平衡常数K(A)<K(B)
D.升高温度,平衡向逆反应方向移动,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入浓硫酸溶液,溶液呈_________色,因为_____________。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__________方向移动(正或逆),溶液颜色将__________(加深或变浅)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W的合成路线如图:
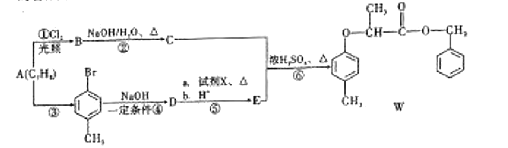
已知:ⅰ.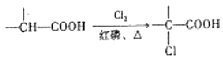 ;
;
ⅱ.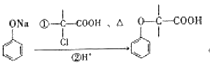 。
。
(1)W中的含氧官能团有醚键和__________,![]() 的反应类型为_____________。
的反应类型为_____________。
(2)D的名称为__________________。
(3)步骤⑥反应的化学方程式为_________________________________________________。
(4)试剂X的结构简式为_______________________。
(5)同时满足下列条件,E的同分异构体有__________种。(不考虑立体异构)
ⅰ.能与![]() 溶液发生显色反应;
溶液发生显色反应;
ⅱ.能发生水解反应和银镜反应;
ⅲ.苯环上只有两个取代基。
其中核磁共振氢谱峰面积比为1∶1∶2∶2∶6的分子的结构简式为_______________。
(6)根据以上信息,写出以![]() 为原料制取
为原料制取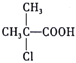 的合成路线图:_____________________________(无机试剂一定要选银氨溶液,其他无机试剂任选)
的合成路线图:_____________________________(无机试剂一定要选银氨溶液,其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200mL饱和CuSO4溶液,a、b、c、d均为石墨电板,通电一段时间后,B池中阴极增重0.64g。
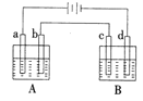
(1)A池中阳极的电极反应式为________。
(2)计算通电过程中A、B两池阳极分别产生气体的体积(标准状况下)__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1 mol HI(g),发生反应2HI(g) ![]() H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。

(1)0~2 min内的平均反应速率v(HI)=______________________。 该温度下,H2(g)+I2(g) ![]() 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_______,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是___________

A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体![]() ,放电时有关离子转化如图所示.下列说法正确的是
,放电时有关离子转化如图所示.下列说法正确的是
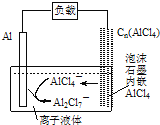
A.放电时,负极发生:![]()
B.放电时,电路中每流过3mol电子,正极减少27g
C.充电时,泡沫石墨极与外电源的负极相连
D.充电时,阴极发生:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com