
【题目】如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200mL饱和CuSO4溶液,a、b、c、d均为石墨电板,通电一段时间后,B池中阴极增重0.64g。
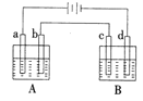
(1)A池中阳极的电极反应式为________。
(2)计算通电过程中A、B两池阳极分别产生气体的体积(标准状况下)__________、_________。
【答案】2Cl--2e-=Cl2↑ 224 mL 112 mL
【解析】
(1)该装置是电解池,电解池工作时,与正极连接的A装置为阳极,阳极上氯离子放电生成氯气,B装置中c电极为阳极,阳极上氢氧根离子放电生成氧气,写出电极反应式;
(2)根据电解池工作时转移电子数相等计算生成的气体体积。
(1)该装置是电解池,电解池工作时,A装置阳极a上发生氧化反应,失去电子,由于放电能力Cl->OH-,所以阳极a上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑;在B装置中,由于阴离子的放电能力:OH->SO42-,所以在阳极c上,OH-离子放电生成O2,电极反应式为:4OH--4e-=2H2O+O2↑;在阴极d上,溶液中的Cu2+获得电子,发生还原反应。
(2)通电一段时间后,B池中阴极增重0.64g,则转移电子的物质的量n(e-)=![]() ×2=0.02mol,由于在同一闭合回路中电子转移数目相等,所以B池阳极上产生氧气的物质的量为n(O2)=
×2=0.02mol,由于在同一闭合回路中电子转移数目相等,所以B池阳极上产生氧气的物质的量为n(O2)=![]() ×0.02mol=0.005mol,则产生的氧气在标准状况下的体积V(O2)=0.005mol×22.4L/mol=0.112L=112mL;在A池阳极上产生Cl2的物质的量n(Cl2)=
×0.02mol=0.005mol,则产生的氧气在标准状况下的体积V(O2)=0.005mol×22.4L/mol=0.112L=112mL;在A池阳极上产生Cl2的物质的量n(Cl2)=![]() ×0.02mol=0.01mol,生成氯气在标准状况下的体积V(O2)=0.01mol×22.4L/mol=0.224L=224mL。
×0.02mol=0.01mol,生成氯气在标准状况下的体积V(O2)=0.01mol×22.4L/mol=0.224L=224mL。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL0.1mol·L-1的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH与CH3COOH溶液体积关系如下图所示,下列有关粒子浓度大小关系正确的是( )

A.a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.水的电离程度:D>B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察以下有机物结构
①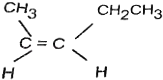 ,②
,②![]() ,③
,③![]()
(1)①②③中最多有几个原子共面?①________,②_________,③__________;
(2)②③中最多有几个原子共线?②__________,③___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用酸碱中和滴定原理测定某市售白醋的含量。
I.实验步骤
(I)量取10.00mL食用白醋,稀释到100mL,得到待测白醋溶液,取待测白醋溶液20.00mL于锥形瓶中,向其中滴加几滴________作指示剂。
(2)碱式滴定管盛装0.1000mol/LNaOH溶液初始时的液面位置如图所示,此时的读数_____mL。
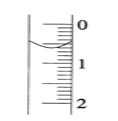
(3)滴定过程中,滴至_________________时即为滴定终点,记录NaOH溶液的最终读数。重复滴定4次。
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol/LNaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | l5.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(4)按实验所得数据,可折算得c(市售白醋)=__________mol/L。
(5)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填选项字母)。
a.碱式滴定管在装液前未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气池,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是
A.0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA
B.常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA
C.标准状况下,0.1mol氯仿的体积为2.24L
D.11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封放置一段时间后,下列有关说法正确的是 ()
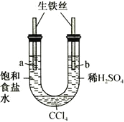
A.a管发生析氢腐蚀,b管发生吸氧腐蚀
B.一段时间后,b管液面高于a管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
浓度 时间 | NO |
|
|
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
35 |
|
|
|
![]() 以v(NO)表示的平均反应速率为 ______ .
以v(NO)表示的平均反应速率为 ______ .
![]() 根据表中数据,计算平衡时的NO转化率为 ______ .
根据表中数据,计算平衡时的NO转化率为 ______ .
![]() 根据表中数据,计算
根据表中数据,计算![]() 时该反应的平衡常数为 ______ .
时该反应的平衡常数为 ______ .
![]() 改变的实验条件是 ______ .
改变的实验条件是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
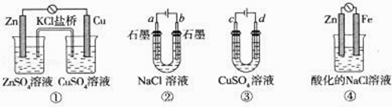
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com