
【题目】25℃时,在25mL0.1mol·L-1的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH与CH3COOH溶液体积关系如下图所示,下列有关粒子浓度大小关系正确的是( )

A.a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.水的电离程度:D>B>A
【答案】C
【解析】
A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使溶液呈中性,酸的量应稍微大些,所以a>25;在B点溶液呈中性,即溶液中氢离子和氢氧根离子浓度相等,所以醋酸根离子和钠离子也相等,但中性溶液中水是微弱电离的,所以醋酸根离子浓度大于氢离子浓度,即c(Na+)=c(CH3COO-)>c(OH-)=c(H+),A错误;
B.在C点,溶液呈酸性,溶液中c(H+)>c(OH-),根据溶液中电荷守恒知,溶液中c(Na+)<c(CH3COO-),所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),B错误;
C.在D点时,加入的醋酸的物质的量n(CH3COOH)=0.2mol/L×0.025L=0.005mol,氢氧化钠的物质的量n(NaOH)=0.1mol/L×0.025L=0.0025mol,根据物料守恒知,n(CH3COOH)+ c(CH3COO-)=0.005mol,所以在D点:n(CH3COOH)+ c(CH3COO-)=2c(Na+),C正确;
D.在A点溶液中含有大量NaOH,对水电离起抑制作用,在B点,溶液的pH=7,对水电离平衡无影响;在D点醋酸过量,对水电离平衡又起抑制作用,但醋酸是弱酸,电离产生的H+浓度很小,抑制作用小于NaOH,所以水的电离程度:B>D>A,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
① | 298 | 0.20mol/L |
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
② | 308 | 0.20mol/L |
| |
③ | 298 | 0.40mol/L |
| |
④ | ______ |
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
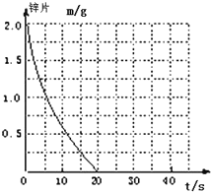
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )

① ② ③ ④
A. ①表示随温度升高,平衡常数的变化
B. ②表示加入催化剂,反应速率随时间的变化
C. ③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D. ④表示CO的体积分数随充入Cl2量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
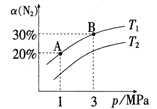
A.将1molN2与3molH2置于1L密闭容器中充分反应,放出的热量为92.3kJ
B.T1<T2
C.平衡状态由A变到B时,平衡常数K(A)<K(B)
D.升高温度,平衡向逆反应方向移动,逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为![]() ,下列有关该电池的说法错误的是( )
,下列有关该电池的说法错误的是( )
A.电池的电解液为碱性溶液,正极为![]() 、负极为
、负极为![]()
B.电池放电时,正极反应为![]()
C.电池充电过程中,阴极附近溶液的![]() 升高
升高
D.电池充电时,阳极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:Cr2O72—+H2O![]() 2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
2CrO42—+2H+现将一定量的K2Cr2O7溶于水配成稀溶液,溶液呈橙色。
(1)向上述溶液中加入浓硫酸溶液,溶液呈_________色,因为_____________。
(2)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向__________方向移动(正或逆),溶液颜色将__________(加深或变浅)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W的合成路线如图:
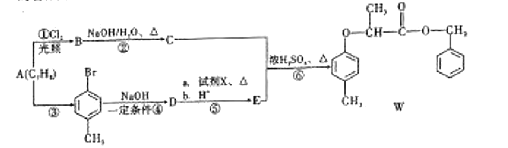
已知:ⅰ.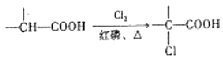 ;
;
ⅱ.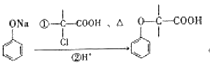 。
。
(1)W中的含氧官能团有醚键和__________,![]() 的反应类型为_____________。
的反应类型为_____________。
(2)D的名称为__________________。
(3)步骤⑥反应的化学方程式为_________________________________________________。
(4)试剂X的结构简式为_______________________。
(5)同时满足下列条件,E的同分异构体有__________种。(不考虑立体异构)
ⅰ.能与![]() 溶液发生显色反应;
溶液发生显色反应;
ⅱ.能发生水解反应和银镜反应;
ⅲ.苯环上只有两个取代基。
其中核磁共振氢谱峰面积比为1∶1∶2∶2∶6的分子的结构简式为_______________。
(6)根据以上信息,写出以![]() 为原料制取
为原料制取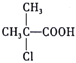 的合成路线图:_____________________________(无机试剂一定要选银氨溶液,其他无机试剂任选)
的合成路线图:_____________________________(无机试剂一定要选银氨溶液,其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200mL饱和CuSO4溶液,a、b、c、d均为石墨电板,通电一段时间后,B池中阴极增重0.64g。
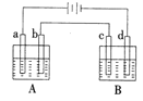
(1)A池中阳极的电极反应式为________。
(2)计算通电过程中A、B两池阳极分别产生气体的体积(标准状况下)__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用
B.在洗净的试管里配制银氨溶液
C.向银氨溶液中滴入3~4滴乙醛稀溶液
D.加热
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________;
(2)简述银氨溶液的配制过程:__________________________________________;
(3)写出乙醛发生银镜反应的化学方程式:_____________________________________;
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如下:![]()
已知:[Ag(NH3)2]+![]() Ag++2NH3
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:__________________________________;
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com