
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为![]() ,下列有关该电池的说法错误的是( )
,下列有关该电池的说法错误的是( )
A.电池的电解液为碱性溶液,正极为![]() 、负极为
、负极为![]()
B.电池放电时,正极反应为![]()
C.电池充电过程中,阴极附近溶液的![]() 升高
升高
D.电池充电时,阳极反应为![]()
科目:高中化学 来源: 题型:
【题目】在恒容的密闭容器内,使 1molN2和3molH2 混合发生下列反应:
3H2+N2![]() 2NH3 H<0
2NH3 H<0
(1) 升高温度时,混合气体的密度_____。(填:“变大”或“变小”或“不变”)
(2)当达到平衡时,充入 N2,平衡将_____移动。(填:“正向”或“逆向”或“不”, 下同)
(3)当达到平衡时,充入Ar气,平衡将_____移动。
(4)当达到平衡时,将 c(N2)、c(H2)、c(NH3)同时增大 1 倍,平衡将_____移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制H2O2过程中,先用电解NH4HSO4(以昂贵的铂作电极)得到过二硫酸。
阳极:2HSO4- ![]() H2S2O8+2e-
H2S2O8+2e-
阴极:2H3O++2e-→H2↑+2H2O
然后过二硫酸水解,最后可以制得H2O2。第一步水解 H2S2O8+H2O—→H2SO4+H2SO5 第二步水解 H2SO5+H2O—→H2SO4+H2O2,则要制得1mol H2O2,电解时转移电子数为( )
A.0.5molB.1molC.1.5molD.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】靠一组镍氢电池驱动,一台试运行的混合动力公交车两年内跑了10万公里。大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车重大专项中一项重要课题。我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+ 6NiO(OH)![]() LaNi5+ 6Ni(OH)2。下列说法正确的是
LaNi5+ 6Ni(OH)2。下列说法正确的是
A.放电时储氢合金作正极B.充电时储氢合金作阳极
C.充电时阳极周围c(OH-)增大D.放电时负极反应:LaNi5H6+ 6OH-- 6e-= LaNi5+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入003 g Zn粉,在相同条件下充分反应,下列有关叙述正确的是
A. 稀释2倍后,两溶液的pH:盐酸小于醋酸
B. 盐酸和醋酸分别与Zn反应放出的氢气一样多
C. 盐酸和醋酸分别与Zn反应的速率一样大
D. 稀释2倍前,醋酸溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在25mL0.1mol·L-1的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH与CH3COOH溶液体积关系如下图所示,下列有关粒子浓度大小关系正确的是( )

A.a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.水的电离程度:D>B>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2L密闭容器中充入5molN2和7molH2。发生反应:N2(g)+3H2(g)![]() 2NH3(g)。请问答:
2NH3(g)。请问答:
(1)该反应的平衡常数表达式为___________
(2)一定温度下,不能说明上述反应已达到平衡的是____________(填选项字母)。
a.NH3的生成速率和NH3的分解速率相等
b.单位时间内消耗amolN2同时生成2amolNH3
c.容器内的压强不再变化
d.容器内的密度不再变化
e.容器内H2的体积分数不再变化
(3)当该反应达到平衡时,测得c(N2)=2.0mol/L,则该温度下反应的平衡常数K=_____。
(4)若在上述平衡条件下保持温度不变,将容器扩大到原来的两倍,再次达到平衡时N2(g)的转化率_______(填“增大”、“减小”或“不变"),c(NH3)____0.5mol/L (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用酸碱中和滴定原理测定某市售白醋的含量。
I.实验步骤
(I)量取10.00mL食用白醋,稀释到100mL,得到待测白醋溶液,取待测白醋溶液20.00mL于锥形瓶中,向其中滴加几滴________作指示剂。
(2)碱式滴定管盛装0.1000mol/LNaOH溶液初始时的液面位置如图所示,此时的读数_____mL。
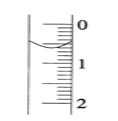
(3)滴定过程中,滴至_________________时即为滴定终点,记录NaOH溶液的最终读数。重复滴定4次。
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol/LNaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | l5.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(4)按实验所得数据,可折算得c(市售白醋)=__________mol/L。
(5)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填选项字母)。
a.碱式滴定管在装液前未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气池,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com